研究ハイライト
植物の気孔の数を調節する二足のわらじの分子メカニズム ~ヒトと共通性を持ち、独自で巧妙な情報伝達〜
名古屋大学トランスフォーマティブ生命分子研究所(ITbM)の鳥居啓子主任研究者/客員教授(米国ワシントン大学教授、ハワードヒューズ医学研究所正研究員)、フロハンス•タマ教授らの研究グループは、植物学と構造生物学を組み合わせ、気孔の発生を制御するタンパク質の三次元構造を解くことにより、気孔の数を適切に調節する分子メカニズムを明らかにしました。
気孔は、ほぼ全ての陸上植物に存在し、光合成のためのガス交換や水分の制御を担っています。葉の表面で気孔が正常に働くには、環境に適合した数の気孔が一定の間隔で作られることが重要です。研究グループらのこれまでの成果から、代表的な陸上植物であるシロイヌナズナでは、細胞どうしのシグナル交換により、MAPキナーゼカスケードと呼ばれる細胞内情報伝達経路を介して、気孔を作る司令因子スピーチレス(SPEECHLESS,SPCH)が制御され、気孔の数が増えすぎないように限定されることがわかっていました。今回、細胞内情報がどうやってSPCHに届けられるのかを明らかにするため、SPCHのパートナー因子であるスクリーム(SCREAM)に着目しました。その結果、SCREAMはMAPキナーゼと強く結合する領域を二ヶ所もち、MAPキナーゼとSPCHを細胞核内で間接的に結合させることがわかりました。SCREAMのMAPキナーゼ結合部位に突然変異が起こるとMAPキナーゼがSPCHを抑制できず、ほぼ全ての葉の表皮が気孔になってしまいます。
さらに、X線結晶解析によるMAPキナーゼの3次元構造とab initio構造モデルを併せて、SCREAMとMAPキナーゼの結合様式を解明しました。MAPキナーゼは、私たちヒトの細胞内情報伝達の根幹をなしており、細胞の増殖や分化、癌化に直接関わっています。本研究から、植物とヒトのMAPキナーゼの構造は殆ど同じであるものの、SCREAMはヒトのMAPキナーゼ基質と共通な結合様式と植物独自の結合様式の2つを駆使して、「遺伝子発現の司令因子であり、かつ、MAPキナーゼがSPCHに作用するための足場タンパク質である」という「二足のわらじ」の役割をもつことが明らかになりました。今回の発見は、ヒトとの共通性を持ちつつも植物が独自で巧妙な情報伝達の仕組みをもつことを示すものといえます。
本研究成果は、令和元年6月17日に英国科学誌Nature Plantsに掲載されました。
【ポイント】
- モデル植物シロイヌナズナの気孔を作る司令因子を制御する分子メカニズムを構造生物学の手法を用いて解明しました。
- 気孔の分化を開始させる司令因子スピーチレス(SPCH)はMAPキナーゼと呼ばれる細胞内情報伝達因子によって制御されますが、SPCHのパートナー因子であるスクリーム(SCREAM)がMAPキナーゼと結合し、シグナル情報伝達を細胞核へ伝えることよってMAPキナーゼとSPCHが間接的に結合し、気孔の数が一定に保たれることがわかりました。
- SCREAMはKRAAM領域と呼ばれるSCREAMに独自に見られるアミノ酸配列を介してMAPキナーゼに結合することがわかりました。突然変異によってSCREAMがMAPキナーゼに結合できなくなると、MAPキナーゼの基質としてタンパク質リン酸化修飾が起こらず、結果としてSCREAMとSPCHの両者が分解されなくなり、表皮細胞の殆ど全てが気孔になります。
- KRAAM領域と呼ばれるSCREAMのMAPキナーゼ結合配列は、スギゴケやイネ、トマトなどの気孔をもつ陸上植物に広く保存されていることもわかりました。
- 構造生物学的解析から、植物のMAPキナーゼ(MPK6)はヒトのMAPキナーゼと殆ど同じ3元立体構造をしているものの、SCREAMはヒトのMAPキナーゼ基質と共通な結合様式と植物独自の結合様式の2つを駆使して、「遺伝子発現の司令因子であり、かつ、MAPキナーゼがSPCHに作用するための足場タンパク質である」という二つの役割をもつことが明らかになりました。
MAPキナーゼは、私たちヒトの細胞内情報伝達の根幹をなしており、細胞の増殖や分化、癌化や細胞死などに直接関わっています。植物のMAPキナーゼも胚発生など様々な発生プロセスのみならず、免疫反応や傷害ストレスの細胞内情報伝達を担っています。植物のMAPキナーゼとSCREAM以外の基質との結合構造はまだわかっていません。今回の発見は、ヒトとの共通性を持ちつつも植物が独自で巧妙な情報伝達の仕組みをもつことを示すとともに、植物の免疫反応やストレス反応などの仕組みの理解と操作へつながるものです。
【研究背景と内容】
植物の気孔は、陸上植物のほぼ全ての種の光合成器官(葉など緑色の部分)の表皮に散在し、ゼリービーンズのような2つの孔辺細胞が小さな穴を囲んだ形をしています。植物は気孔を介して二酸化炭素を取り込み、光合成の副産物である酸素を大気中に放出することにより、地球環境に貢献しています。また、気孔から蒸散する水蒸気は、私たちが汗をかくように、葉の表面温度を下げる効果も持っています。一方、乾燥条件下では、気孔が閉まることにより枯死を防いでします。このように植物がガス交換と水分制御をするためには、気孔の数が一定数に保たれ、かつ、散在している必要があります。例えば、気孔が大量に塊ってできてしまうと、ちゃんと閉じることができず、植物は萎れやすくなりますし、気孔の穴を介して病原菌などが入り込んだりします。
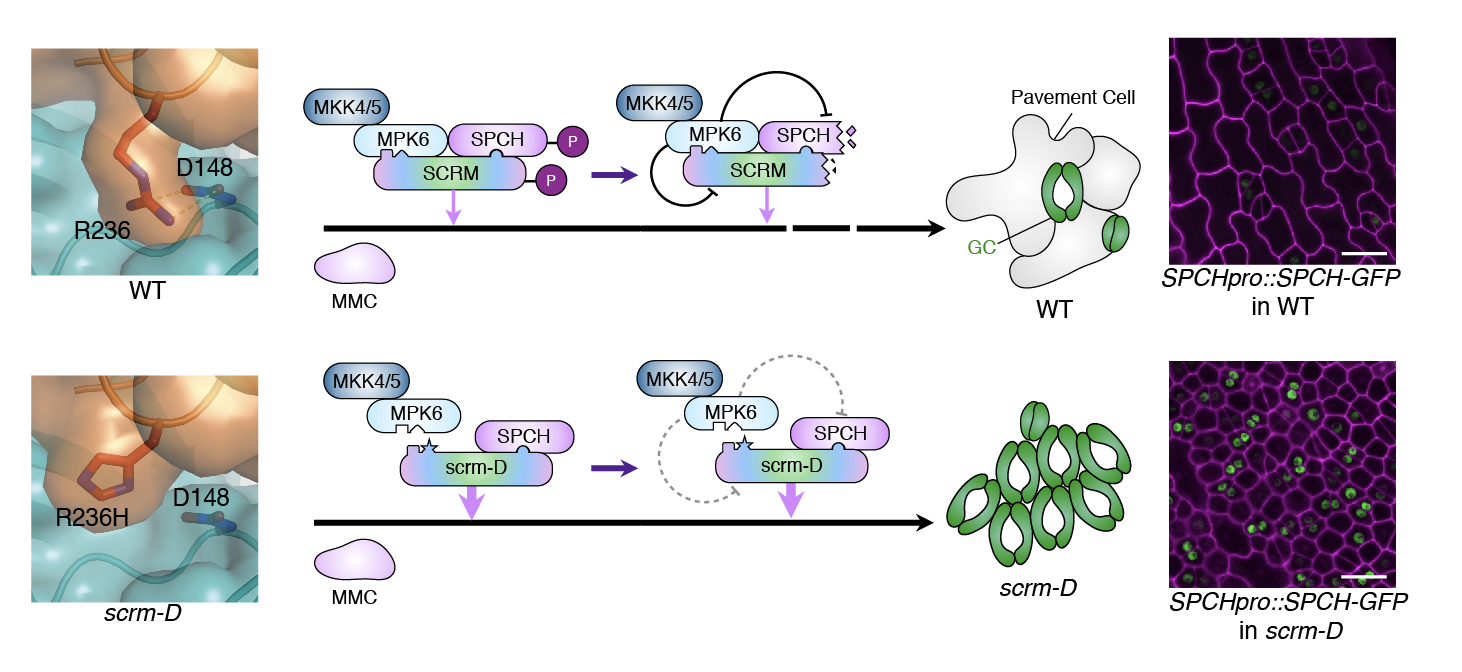
過去10数年の本研究グループや他グループによるモデル植物シロイヌナズナを用いた発生遺伝学的研究から、スピーチレス(SPEECHLESS, SPCH)と呼ばれる司令因子と、その二量体パートナー因子スクリーム(SCREAM)によって、気孔発生の遺伝子発現プログラムが開始することがわかっていました。一方、隣接した細胞が気孔にならないよう、気孔系譜の細胞は互いにペプチドホルモンを分泌します。このホルモンは、隣の細胞の受容体に結合し、MAPキナーゼカスケードと呼ばれる細胞内の情報伝達経路を活性化することにより、最終的にSPCHを抑制し気孔の発生を負に制御することがわかっていました。しかし、MAPキナーゼはSPCHと直接は結合しないため、どのようにしてSPCHを抑制するのかわかっていませんでした。また、研究グループは、過去にSCREAMの機能亢進型の突然変異体scream-Dを見つけて報告していました。このscream-D変異体では、葉の表面の殆ど全てが気孔になってしまいます。scream-D変異体ではSCREAMタンパク質の1アミノ酸が別のアミノ酸に置換していますが、なぜ、たった1アミノ酸の突然変異で「気孔だらけ(叫び:scream)」の特殊な葉が発生するのか全く解っていませんでした。
SPCHの抑制には、MPK3とMPK6という2種類のMAPキナーゼが関わっていることから、研究グループは、まず、SCREAMの役割を調べました。その結果、SCREAMが、糊のようにMPK3/6とSPCHを結びつけていることがわかりました。SCREAMはSPCHと二量体を作ることが知られていますが、一方でSCREAMがどうやってMAPキナーゼと結合するのかはわかっていませんでした。そこで、陸上植物のSCREAMタンパク質の配列を比較検討したところ、SCREAMタンパク質ファミリーにはこのファミリーに特徴的な保存配列KRAAM領域が見つかり、またその近傍にはヒトなど動物で知られるMAPキナーゼ結合配列と似た領域が存在することがわかりました(図1)。解析の結果、KRAAM領域とMAPキナーゼ結合配列様領域の両方が、MAPキナーゼ結合部位であることがわかりました。葉の表皮が気孔だらけになるscream-D変異体では、KRAAM配列がKHAAMとアミノ酸のアルギニン(R)からヒスチジン(H)残基に変異しています。このscream-D(KHAAM)変異は、MPK3/6の両者と全く結合できないこともわかりました(図1)。
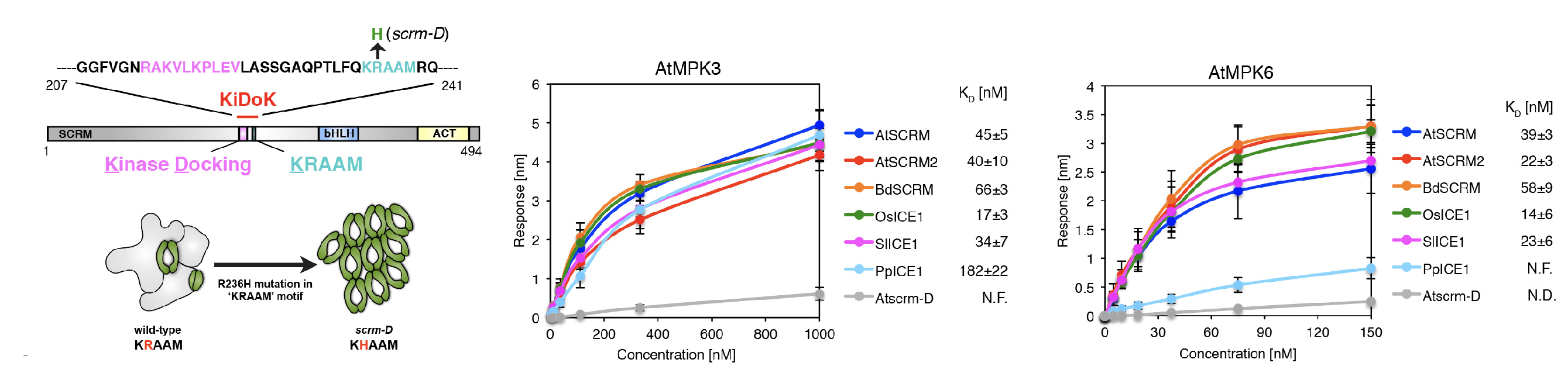
図1:SCREAMタンパク質の模式図(左)および、様々な植物種のSCREAMとMAPキナーゼ(MPK3,中、MPK6,右)の結合の定量解析.アルギニン(R)残基がヒスチジン(H)残基に置換したSCREAMタンパク質(scrm-Dタンパク質)は、MAPキナーゼに結合できず、結果として気孔だらけの葉になってしまう
次に、シロイヌナズナのMPK3およびMPK6タンパク質と、様々な陸上植物種のSCREAMタンパク質のKRAAM-MAPキナーゼ結合領域との結合キネティクスを定量解析したところ、様々な植物種のSCREAMタンパク質はシロイヌナズナSCREAMと同じようにMPK3およびMPK6タンパク質と結合することがわかりました。面白いことに、コケのSCREAMタンパク質(Physomitrella patens ICE1と呼ばれています)はMPK3とのみ結合し、MPK6とは結合しませんでした。コケのSCREAMにはKRAAM領域は保存されているものの、近傍のMAPキナーゼ結合配列は存在しません(図1)。そこで、同じように、シロイヌナズナSCREAMからもそのMAPキナーゼ結合配列を削り取ったところ、MPK3とは結合するもののMPK6とは結合しないことがわかりました。これまでに、気孔の発生にMPK3とMPK6は全く同じように作用すると考えられていましたが、今回の結果からは、KRAAMとMAPキナーゼ結合配列は、MPK3とMPK6に対して異なる結合能力を持つことが示唆されます。実際に、これらKRAAM領域にさらなる変異を加えたSCREAMや、MAPキナーゼ結合配列様領域を削除したSCREAMをシロイヌナズナに導入したところ、scream-D変異と同じように表皮が気孔だらけになってしまいました(図2)。

図2: MAPキナーゼと結合できないバージョンのSCREAMは、どれも皆、気孔だらけの葉
次に、MAPキナーゼとSCREAMがどのように結合するのかを解き明かすため、MPK6のX線結晶構造を2.75Å(オングストローム)の解像度で明らかにしました。残念ながらSCRMのKRAAM断片はMPK6と共結晶しなかったため、ab initio構造モデル予測法を用いて推定し、実験によって推定モデルの正しさを検証しました。これらの解析から、MPK6のCD領域と呼ばれるMAPキナーゼ基質結合部位にSCREAMのMAPキナーゼ結合配列様領域が結合することがわかりました。一方、KRAAM領域はMAPキナーゼの全く別の部位の結合し、KRAAM領域のアルギニン残基(R236)とMPK6のアスパラギン酸残基(D148)とが相互作用することがわかりました(図3A)。このR236残基は、scrm-D突然変異体でヒスチジン残基に変異しているアミノ酸そのものです。
さらに、シロイヌナズナのMPK6の三次元構造をヒトのMAPキナーゼ(ERK2)と比較したところ、ほとんど同じ構造であることがわかりました(図3B)、SCREAMのMAPキナーゼ結合配列様部位は、ヒトのMAPキナーゼが基質と結合する様式と同じように結合することがわかりました。一方、SCREAMのKRAAM領域と結合するMPK6部位(D148)は、ヒトMAPキナーゼと保存されていない植物のMAPキナーゼに独自の配列であることがわかりました。SCREAMのKRAAM領域は、植物のSCREAMファミリー因子にしか存在しません。そのため、植物に特異的なMAPキナーゼ結合配列と動植物に保存された結合配列の2つを用いて、発生の司令因子にまで細胞内情報伝達が伝わることが示されました。
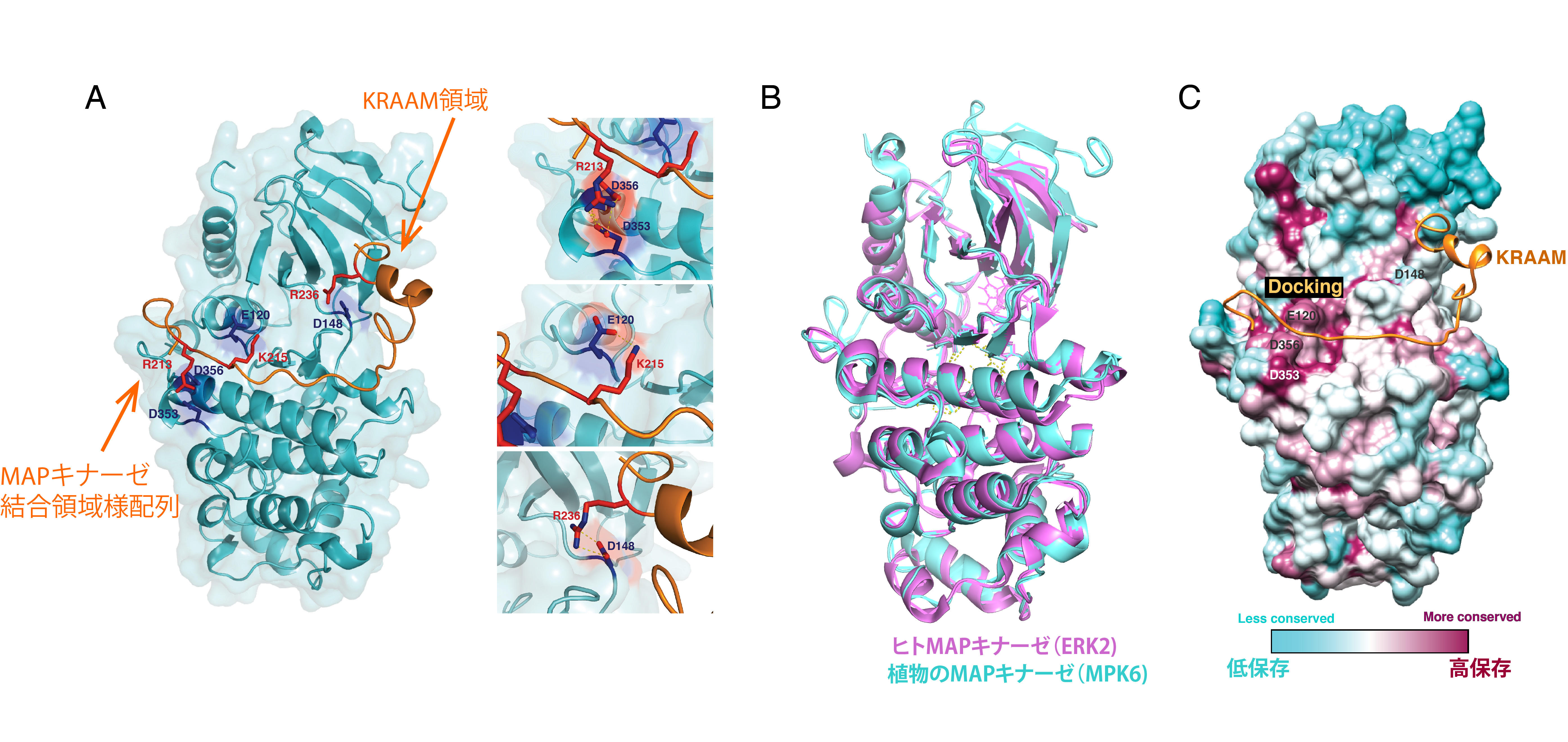
図3:植物のMAPキナーゼ(MPK6)の3次元構造とSCREAMとの結合様式、および ヒトMAPキナーゼとの比較解析.(A)MPK6のX線結晶構造とab initioモデルによるSCREAM(オレンジ)の結合。SCREAMはKRAAM領域とMAPキナーゼ結合配列様領域の2カ所でMPK6に結合することがわかった。特に結合に重要なアミノ酸は右に拡大図で示す。(B)ヒトMAPキナーゼ(ERK2)と植物のMAPキナーゼ(MPK6)の3次元構造を重ね合わせたもの。非常に似ていることがわかる。(C) 植物のMAPキナーゼ(MPK6)と ヒトの6種類のMAPキナーゼを重ね合わせた立体構造。高く保存されている部分はえんじ色、低い部分は水色で示す。SCREAMのMAPキナーゼ結合領域様配列(オレンジ)は、高度に保存されたMAPキナーゼ領域に結合する一方、SCREAMにのみ存在するKRAAM領域(オレンジ)は、植物のMAPキナーゼに特異的な領域に結合する。
では、MAPキナーゼとSCREAMが結合できなくなると、どうして気孔だらけの葉ができるのでしょうか?この謎を解くために、さらに生化学的解析を進めたところ、MAPキナーゼはSCREAMタンパク質をリン酸化し、そのリン酸化修飾が目印となって、SCREAMタンパク質とSPCHタンパク質の分解が引き起こされることがわかりました。しかし、KRAAM配列に変異を持つSCREAMタンパク質(scrm-Dタンパク質)は、そもそもMAPキナーゼと相互作用できないため、リン酸化修飾を受けず、結果としてSCREAMタンパク質とSPCHタンパク質の両者がほぼ全ての表皮で安定に蓄積するため、どの細胞も気孔に分化してしまうことが解りました(図4)。すなわち、本研究によって、細胞内シグナルがどうやって気孔の数の制御に繋がるのか、その詳細が3次元立体構造レベルで解明されました。
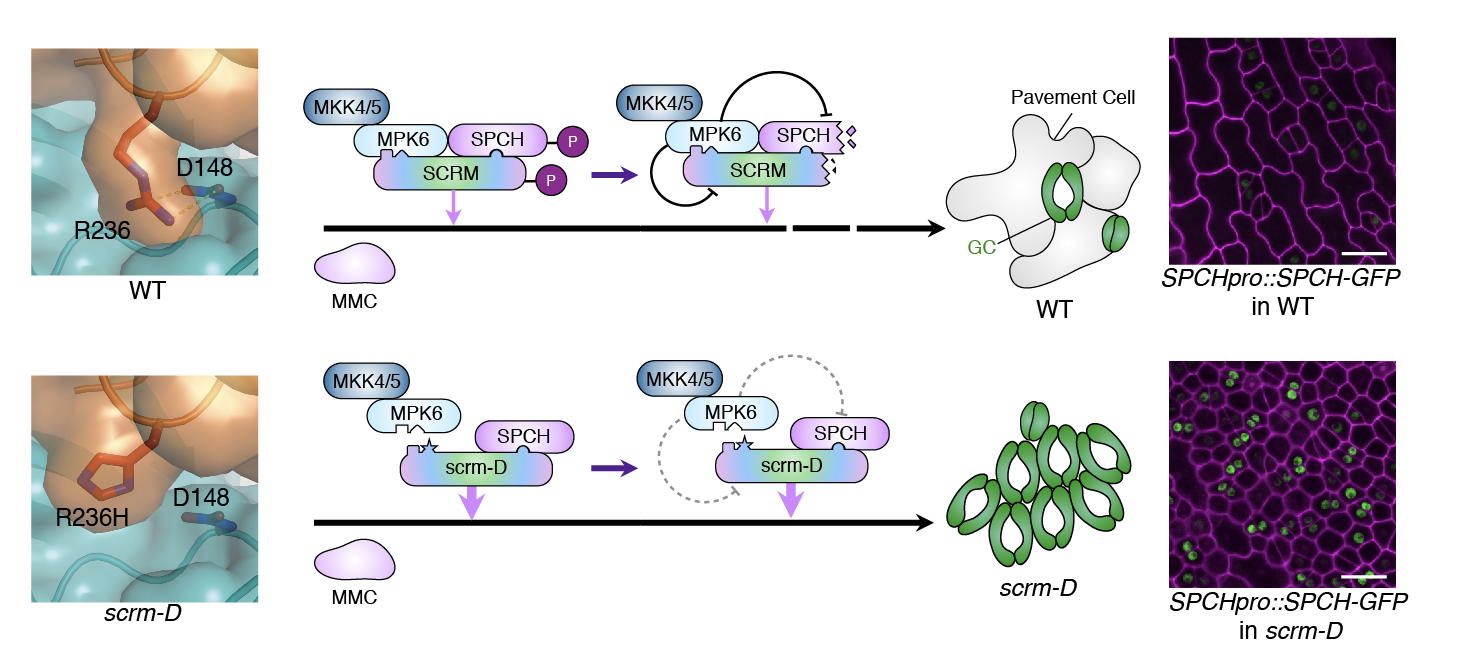
図4:MAPキナーゼとSCREAMの結合の3次元構造から明らかになった、気孔の数を制御する巧妙な仕組み.(上)正常な葉では、SCREAM(SCRM)がKRAAM領域(左)とMAPキナーゼ結合配列様領域の2カ所でMAPキナーセ(MPK6)と結合する。その結果、SCREAMとSPCHの両者が、MAPキナーゼによるリン酸化修飾を受け、分解され、気孔の分化が抑制される。左の分子図は、SCREAM KRAAM領域のアルギニン残基と MPK6のアスパラギン酸残基の結合を示す。(下) scream-D変異体では、KRAAM領域のアルギニン残基がヒスチジン残基に置換しており、MPK6のアスパラギン酸残基と結合できない。その結果、SCREAMはリン酸化修飾を受けず、SCREAMとSPCHの司令因子二量体がほぼ全ての細胞核で蓄積し、気孔だらけの葉ができる。
MAPキナーゼは、私たちヒトの細胞内情報伝達の根幹をなしており、細胞の増殖や分化、癌化や細胞死などに直接関わっています。植物のMAPキナーゼも、胚発生など様々な発生プロセスのみならず、免疫反応や傷害ストレスの細胞内情報伝達を担っています。植物のMAPキナーゼとSCREAM以外の基質との結合構造はまだわかっていません。今回の発見は、ヒトとの共通性を持ちつつも植物が独自で巧妙な情報伝達の仕組みをもつことを示すとともに、植物の免疫反応やストレス反応などの仕組みの理解と操作へつながるものです。
論文情報:
掲載雑誌: Nature Plants
論文名: Bipartite anchoring of SCREAM enforces stomatal initiation by coupling MAP Kinases to SPEECHLESS.
(SCREAMは2つのMAPキナーゼ結合部位を介してSPEECHLESSにつなぐことにより気孔の発生を制御する)
著者: Putarjunan, A., Ruble, J., Srivastava, A., Zhao, C., Rychel, A.L., Hofstetter, A.K., Tang, X., Zhu, J.K., Tama, F., *Zheng, N., and *Torii, K.U. Nature Plants,
DOI: 10.1038/s41477-019-0440-x
リンク:



関連記事・報道:
- 中日新聞 「気孔の数 タンパク質が調節 」(2019.6.20 25面)
2019-06-18

