研究ハイライト
概日リズム周期の光による可逆的な操作
国立大学法人東海国立大学機構 名古屋大学トランスフォーマティブ生命分子研究所(WPI-ITbM)の廣田 毅 特任准教授とサイモン ミラー 研究員のグループ、および伊丹 健一郎 教授と大島 豪 日本学術振興会特別研究員のグループは、オランダ·グローニンゲン大学のBen Feringa 教授とDušan Kolarski 研究員のグループと共同で、概日時計の周期を延長させる新たな低分子化合物を見出し、時計タンパク質のCRY1に選択的に作用することを発見しました。さらに、化合物がCRY1の構造変化を引き起こすことをX線結晶構造解析によって明らかにしました。これらの知見に基づき、化合物の一部を光スイッチに置き換えることで、CRY1の機能と概日リズムの周期を光によって可逆的に操作することに世界で初めて成功しました。概日時計は睡眠·覚醒などのさまざまな生理現象に見られる1日周期のリズムを支配しており、その機能が乱れると睡眠障害やメタボリックシンドローム、がんなどの疾患に影響を及ぼすことが指摘されています。概日時計の機能を自在に操作することができれば、生物が1日の時間を測る仕組みの理解だけでなく、概日時計が関連する疾患の治療に向けた起点ともなります。今回の成果により、概日時計の自在な操作に新たな道が拓けると期待されます。
本研究成果は、2021年1月19日(火)に米国化学会誌「Journal of the American Chemical Society」に掲載されました。
【研究の背景】
朝目覚めて、夜眠るというように、私たちの生命活動の多くは1日の周期で繰り返します。これらのリズムを司る体内の仕組みを「概日時計」と呼びます。概日時計は、時計遺伝子ならびに時計タンパク質注1)の相互作用によって構成されますが、どのように1日という長い周期で、しかも、安定して時を刻むことができるのか、その仕組みはこれまで謎に包まれていました。研究チームはこの問題に取り組むため、化合物が概日リズムに与える影響をヒトの培養細胞を用いて大規模に解析する手法を確立し、化学と生物学とを融合させたケミカルバイオロジー注2)の手法を応用することで、1日周期の決定に関わる重要な分子機構を明らかにしてきました。作用メカニズムが不明であった化合物を詳細に解析することにより、概日時計の制御機構の理解が深まるとともに、機能制御への応用が可能になると期待できます。
さらに、概日時計機構は全身の細胞に存在することから、その全体像の解明には、化合物の作用を時間·空間的に制御することで概日時計を局所的に操作する技術が必要と考えられます。近年、光応答性の分子を用いて化合物の作用を制御する手法として光薬理学が注目を集めていますが、光スイッチとしてよく用いられるアゾベンゼン注3)は一般的にシス体の安定性が低く、概日リズムのような長い時間スケールの生命現象への応用は困難であると考えられていました。
【研究の内容】
今回、研究チームはまず、概日リズムの周期を延長させる新たな化合物として大規模解析から見出したTH303およびその類似化合物であるTH129(図1)の作用メカニズムを解析しました。その結果、これらの化合物は時計タンパク質であるCRY1を安定化して活性化する一方、類似タンパク質であるCRY2には作用しないことを明らかにしました。CRY1とCRY2は非常によく似ているため、選択性を示す化合物の開発は非常に困難であると考えられてきました。そのため、TH303とTH129の作用の選択性に関する発見は大きな驚きでした。
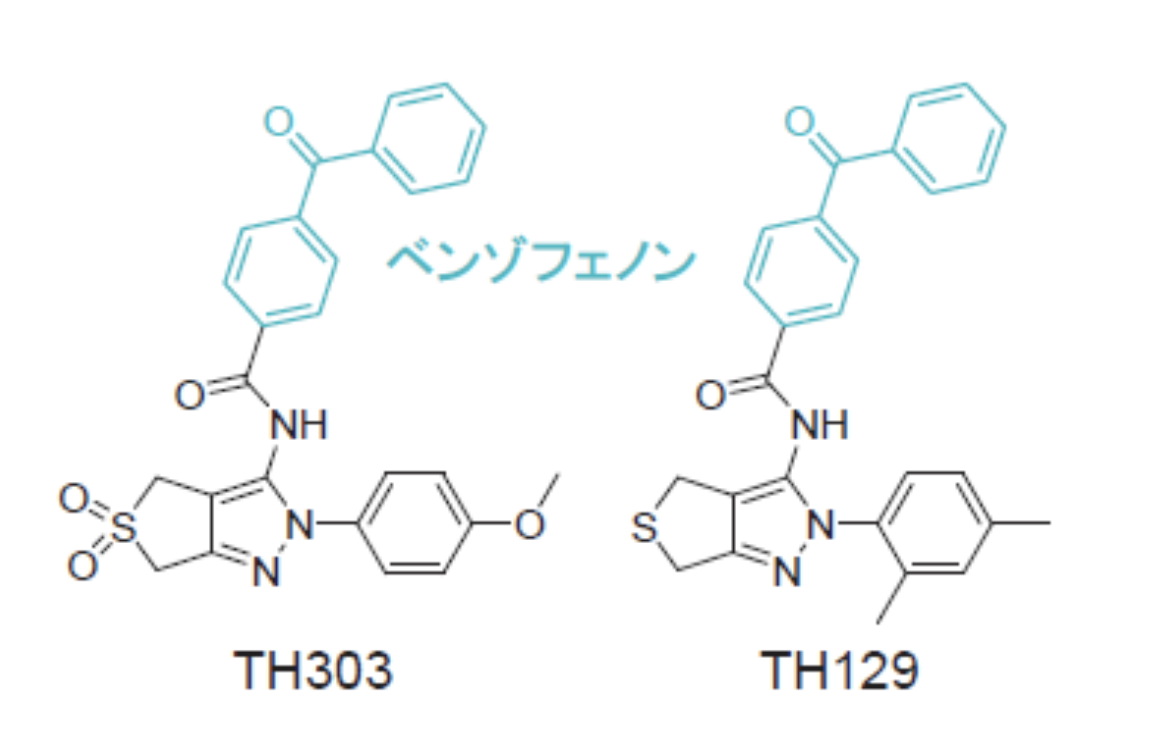
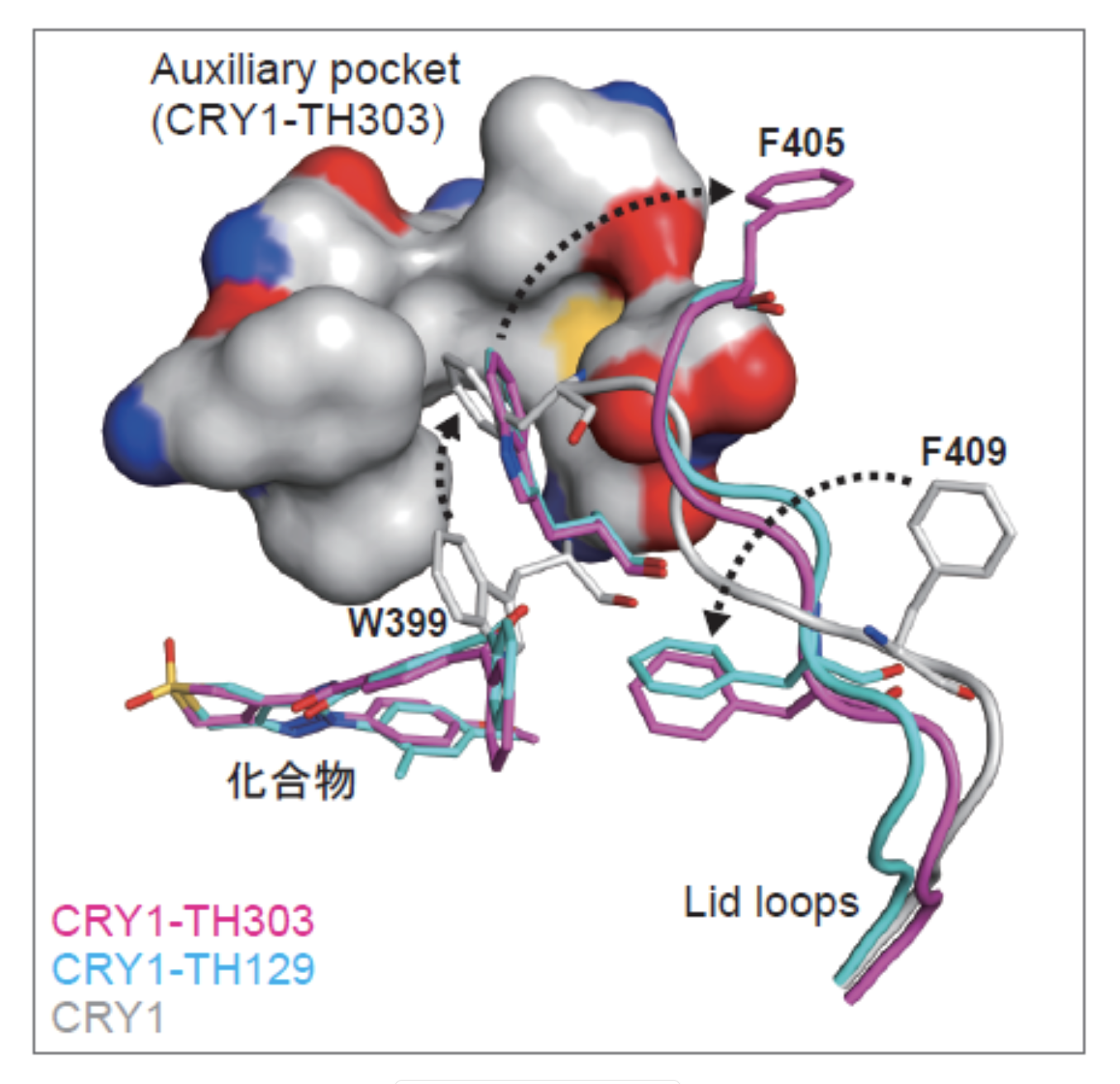
研究チームは次に、これらの化合物がどのように働くのかを知るため、X線結晶構造解析注4)によって、CRY1との相互作用の原子レベルでの解明に取り組みました。その結果、化合物のうちベンゾフェノンと呼ばれる部分(図1)がCRY1の409番目のフェニルアラニン(F409)と相互作用してlid loopという領域の構造を変化させることが判明しました(図2)。ベンゾフェノンの置換やF409の変異によって化合物の効果が失われたことから、この相互作用が重要であると考えられました。
ここで研究チームは、ベンゾフェノンが光スイッチであるアゾベンゼンのシス体と類似した3次元構造をもつことに注目しました(図3A)。TH129のベンゾフェノンをアゾベンゼンに置換した化合物GO1323(図3B)を合成して光応答を解析した結果、紫外光によってシス体に、白色光によってトランス体に、それぞれ高い効率で構造変化することを見出しました。さらに驚いたことに、シス体のGO1323は半減期が1日以上と長く、非常に高い安定性を示すことが判明しました。コンピューターを用いたシミュレーションから、シス体のGO1323はTH129と同様にCRY1のF409と相互作用するのに対し、トランス体は相互作用しないと予想されました。そこで、CRY1と化合物の相互作用を実験的に解析したところ、GO1323は予想通り光に依存してCRY1と相互作用することがわかりました。
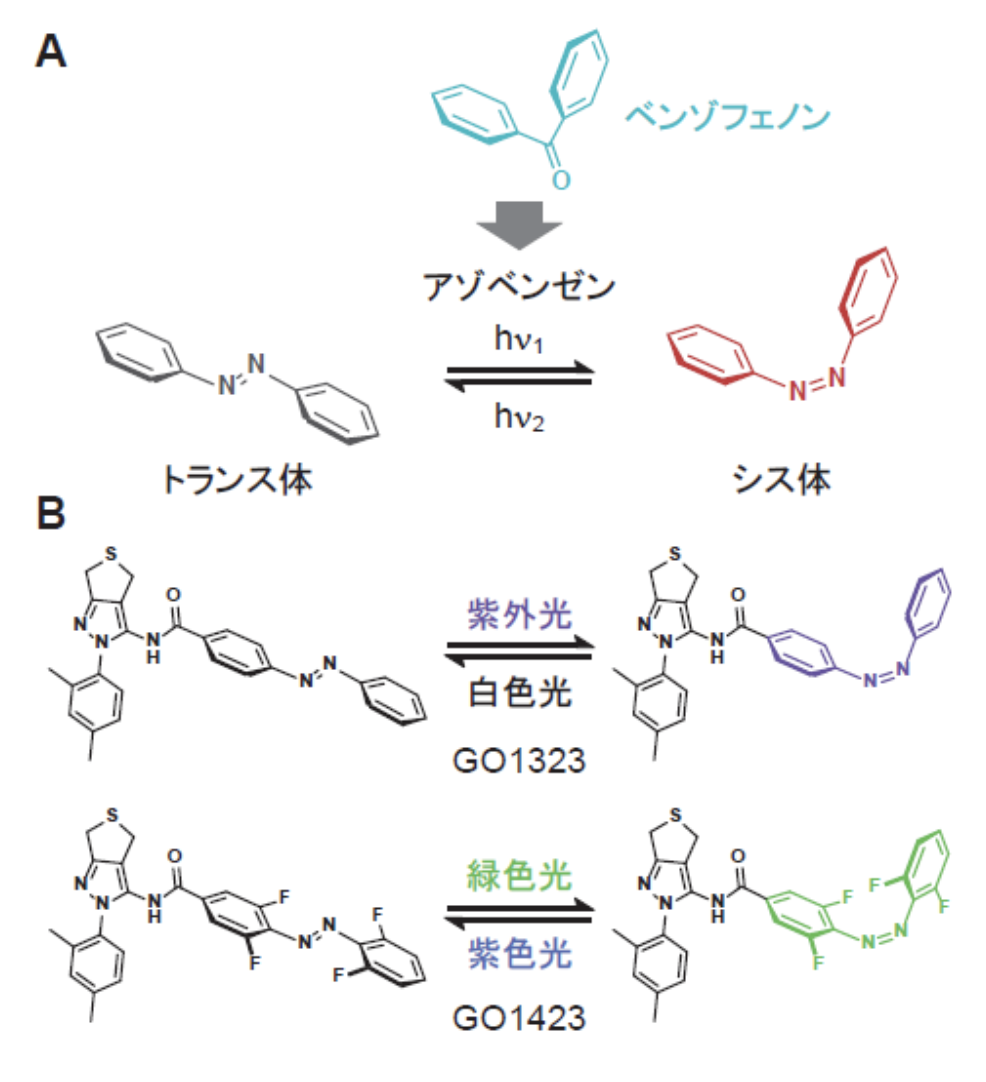
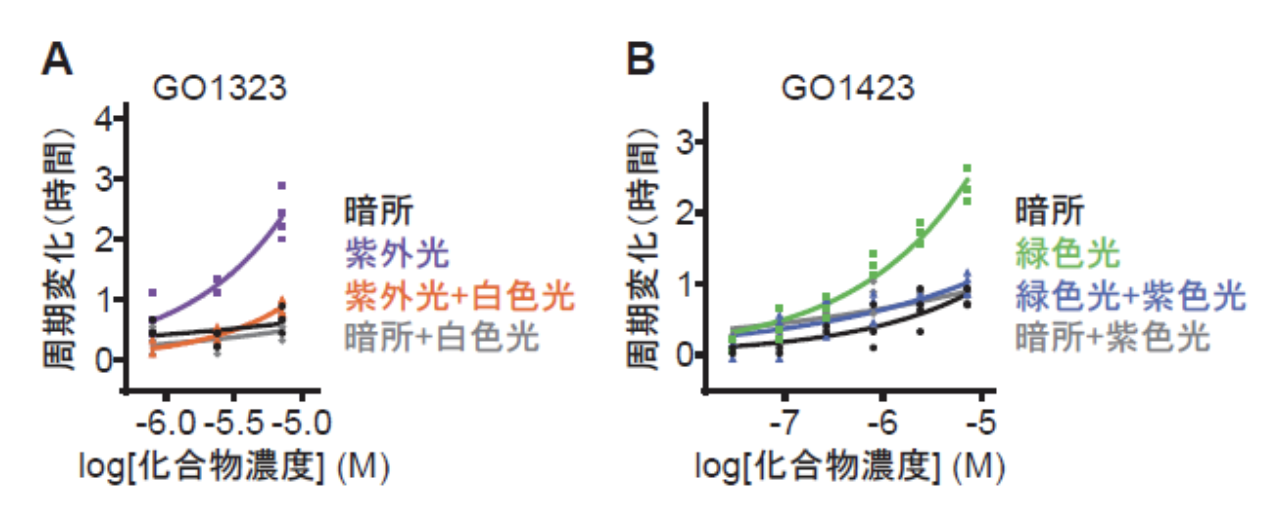
あらかじめ紫外光を照射したGO1323をヒト培養細胞に投与して概日リズムに与える影響を解析した結果、光を当てなかった場合(暗所)と比べて周期が延長することを見出しました(図4A)。さらに、この細胞に白色光を照射したところ、周期延長効果が消失しました。すなわち、概日リズム周期の光による可逆的な操作が可能となりました。しかしながら、紫外光は細胞毒性を示すことから、細胞への照射には向いていません。そこでテトラオルトフルオロアゾベンゼンをもつGO1423(図3B)を合成しました。その結果、この化合物は緑色光によってシス体に、紫色光によってトランス体に、それぞれ高い効率で構造変化し、シス体の半減期は1日以上と、GO1323と同様に優れた性質を示しました。GO1423を細胞に投与した後に緑色光を照射したところ、光を当てなかった場合(暗所)と比べて周期が延長し、さらに紫色光を照射したところ、周期延長効果が消失しました(図4B)。以上の結果から、可視光を用いて概日リズムの周期を可逆的に変化させることに成功しました。
【今後の展望】
CRY1とCRY2は非常に類似したタンパク質であり、共通した働きをもつと考えられてきましたが、近年、両者の異なる作用が注目を集めています。今回の研究では、最先端のケミカルバイオロジーと光薬理学の応用により、CRY1を選択的に、かつ光を用いて自在に調節することで概日リズムの周期を可逆的に変化させることを実現しました。
X線結晶構造解析により、CRY1のlid loopという、結合ポケットの外に存在する領域が化合物のターゲットとしてベンゾフェノンと相互作用することが明らかになりました。さらに、これまで化合物へのアゾベンゼンの導入は容易ではありませんでしたが、ベンゾフェノンがアゾベンゼンを導入するためのよいプラットフォームになることを見出しました。構造解析からタンパク質に作用する化合物の重要部分を特定し、そこに光スイッチをデザインして導入する本研究のアプローチは、今後の光薬理学研究を加速させると考えます。
今回得られたGO1423は、そのシス体が安定であり、有用な研究ツールとしてCRY1の機能解明に役立つに違いありません。CRY1は睡眠相障害や糖尿病、がんなどにも関与することから、将来的にはGO1423の誘導体の解析がこれらの疾患の治療に役立つと期待されます。
本研究は、上記3グループとITbMのフロハンス タマ 教授および佐藤 綾人 特任准教授の各グループの共同で行われました。
【用語説明】
注1)時計遺伝子ならびに時計タンパク質:概日時計が働くために必要な遺伝子とタンパク質。哺乳類においてはPER1、PER2、CRY1、CRY2、CLOCK、BMAL1の6種類が知られている。これらの遺伝子やタンパク質の機能制御が概日時計の働きに重要な役割を果たすと考えられている。
注2)ケミカルバイオロジー:化学の力を応用して生物学の謎に取り組む手法。本研究では概日リズムに影響を与える新たな化合物を用い、作用機序を解明した。
注3)アゾベンゼン:図3Aに示す構造をもつ化合物。紫外光によってトランス体からシス体に、白色光によってシス体からトランス体に構造変化する。置換基によって吸収波長が変化する。本研究ではテトラオルトフルオロアゾベンゼンを用いて可視光による制御を可能にした。
注4)X線結晶構造解析:結晶にX線を照射し、その回折像を見て分子の3次元構造を明らかにする手法。本研究ではSPring-8ならびに高エネルギー加速器研究機構の大型放射光施設を用いて実験を行った。
【論文情報】
雑誌名: Journal of the American Chemical Society
論文タイトル: Photopharmacological manipulation of mammalian CRY1 for regulation of the circadian clock
著者: Dušan Kolarski, Simon Miller, Tsuyoshi Oshima, Yoshiko Nagai, Yugo Aoki, Piermichele Kobauri, Ashutosh Srivastava, Akiko Sugiyama, Kazuma Amaike, Ayato Sato, Florence Tama, Wiktor Szymanski, Ben L. Feringa, Kenichiro Itami, and Tsuyoshi Hirota
論文公開日: 2021年1月19日
DOI: 10.1021/jacs.0c12280
URL: https://pubs.acs.org/doi/pdf/10.1021/jacs.0c12280
本研究は、文部科学省世界トップレベル研究拠点プログラム 名古屋大学 トランスフォーマティブ生命分子研究所(WPI-ITbM)、科学技術振興機構 戦略的創造研究推進事業さきがけ(JPMJPR14LA)、文部科学省 科学研究費助成事業 基盤研究(B)(18H02402)、挑戦的研究(萌芽)(20K21269)、特別推進研究(JP1905463)、武田科学振興財団 ライフサイエンス研究奨励、上原記念生命科学財団 研究奨励金の支援のもとで行われたものです。
2021-01-23

