研究ハイライト
よく似たタンパク質を見分ける仕組みを発見!~「概日時計」の分子メカニズムの解明に更なる前進~
国立大学法人東海国立大学機構 名古屋大学トランスフォーマティブ生命分子研究所(WPI-ITbM※)の廣田 毅 特任准教授とサイモン ミラー 研究員は、ITbMのフロハンス タマ 教授とアシュトシュ スリバスタバ 研究員との共同研究で、「概日時計」を構成する非常によく似たタンパク質の間で、化合物を見分ける仕組みを明らかにしました。
細胞には1日周期のリズムを支配する概日時計があり、それを構成する時計タンパク質注1)「CRY1」と「CRY2」の役割の違いを明らかにするには、これらを見分ける化合物が必要です。しかし、両者はアミノ酸配列がよく似ているため、どちらか片方を見分ける化合物を作り出すのは困難でした。
本研究では、この2つのタンパク質の結晶構造を解析し、両者の間では化合物に作用する部位のアミノ酸配列が同じであるにもかかわらず、その向きが異なることを発見しました。さらに、この向きを逆方向に人為的操作したところ、両者は逆の化合物を選択することがわかりました。
今後、このよく似たタンパク質を見分ける仕組みをもとに、概日時計の分子メカニズムの解明がさらに進むと期待されます。また、本研究により、よく似たタンパク質の働きを操作する化合物の開発が期待されます。
本研究成果は、2021年6月28日、米国科学誌「Proceedings of the National Academy of Sciences」に掲載されました。
【ポイント】
- 時計タンパク質の「CRY1」と「CRY2」の結晶構造を決定し、両者の違いを明らかにした。
- 「ゲートキーパー」と名付けたアミノ酸の向きおよび「lid loop」注2)領域との相互作用がCRY1とCRY2で異なり、化合物の選択性に関与すると考えられる。
- ゲートキーパーとlid loopの相互作用を変化させると、化合物の選択性が逆転した。
- 配列が同じでも、向きの違いによって選択性が生み出されることを見出した。
【研究の背景】
朝目覚めて、夜眠るというように、私たちの生命活動の多くは1日の周期で繰り返します。これらのリズムを司る体内の仕組みを「概日時計」と呼びます。概日時計は、時計遺伝子ならびに時計タンパク質の相互作用によって構成されますが、1日という長い周期で、どのように安定して時を刻むことができるのか、その仕組みは未だ謎に包まれています。この問題に取り組むため、化合物が概日リズムに与える影響を、ヒトの培養細胞を用いて大規模に解析する手法を確立し、化学と生物学とを融合させたケミカルバイオロジー注3)の手法を応用することで、1日周期の決定に関わる分子機構を明らかにしてきました。 見出した化合物のうち、「KL001」は、時計タンパク質の「CRY1」と「CRY2」の両方に作用します。CRY1とCRY2は共通した役割だけでなく、互いに異なる働きをします。そのため、これらのタンパク質をそれぞれ選択的に機能操作することは非常に有効です。しかし、両者はよく似ているため、選択的な化合物を作り出すことは困難でした。一方、新しい化合物の解析から、CRY1とCRY2のそれぞれに選択性を示す化合物として「KL101」と「TH301」を発見しました。さらに、KL101とTH301の選択性には、化合物が相互作用する領域(結合ポケット)の外に存在する「CRYのC末端領域(CCT)」が必要であることが判明しました。しかし、結合ポケットのアミノ酸配列はCRY1とCRY2の間で同じであるため、化合物がどのように選択されるのか、その詳細は不明でした。
【研究の内容】
今回、化合物が相互作用していない状態のCRY1とCRY2(apo型と呼ぶ)の構造を、X線結晶構造解析注4)によって決定しました。これまでにもCRY1とCRY2のapo型の結晶構造は報告されていましたが、結合ポケットおよびその周辺領域の構造が明確ではなく、化合物の選択性について議論することが困難でした。今回の解析から、結合ポケットおよびその周辺の「lid loop」領域に存在するアミノ酸について、側鎖の向きが明らかになりました。
さらに分子動力学シミュレーション注5)を行うことで、どのアミノ酸残基が安定して存在する(動きにくい)のかを解析しました。その結果、CRY1とCRY2の間でアミノ酸配列は同じであるものの、その向きが異なることを発見しました(図1)。すなわち、CRY1の399番目のトリプトファン(W399)の側鎖は、ポケットの外側に向いているのに対し("out")、これに相当するCRY2の417番目のトリプトファン(W417)の側鎖はポケットの内側に向いていました("in")。これらの向きは、分子動力学シミュレーションにおいて、比較的安定していました。
CRY1の「W399("out")」はlid loopに存在する「Q407」と相互作用を形成するのに対して、CRY2の「W417("in")」は「F424」と相互作用し、結果としてlid loopの一部(CRY1のF406とQ407、CRY2のF424とQ425)がCRY1とCRY2の間で反転していることを見出しました(図1)。 一方、CRY1の「H355」と「H359」(CRY2のH373とH377に相当)もCRY1とCRY2の間で向きに違いがありましたが、シミュレーションの結果、これらの部位は大きく動き、CRY1とCRY2の間の差は小さいことが判明しました。
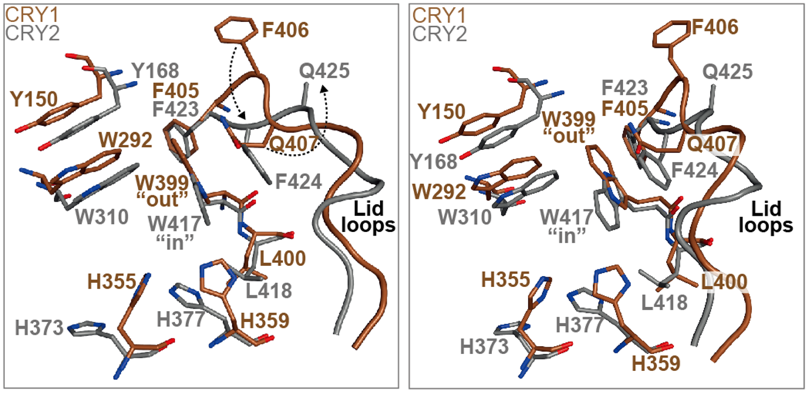
図1. CRY1とCRY2の化合物結合ポケットの構造
右図はCRY1 W399とCRY2 W417を見やすくするために左図を回転させたもの
次に、CRY1のW399とCRY2のW417の向きの違いが、化合物の選択性に関係するのかを調べるため、以前に決定したCRY1とKL101およびTH301の複合体(CRY1-KL101およびCRY1-TH301)、ならびに今回決定した「CRY2-TH301」の結晶構造と比較しました(図2A)。 その結果、CRY1に選択的なKL101はCRY1のW399の向きを、CRY2に選択的なTH301はCRY2のW417の向きを、それぞれのapo型から変化させないことを見出しました。一方、TH301はCRY1のW399の向きを"in"に変化させていました。さらに、KL101を「CRY2-apo」に重ね合わせたモデルを作成したところ、KL101が"in"の位置にあるW417と衝突すると考えられました。
以上の解析により、このトリプトファン残基の向きと化合物の選択性が一致したことから、これを「ゲートキーパー」と呼ぶことにしました。一方、CRY1とCRY2の両方に作用する「KL001」について、既に報告されている「CRY2-KL001」、および今回決定したCRY1-KL001の結晶構造と比較したところ(図2B)、apo型のゲートキーパーの向きのままKL001が結合ポケットに収まることが判明しました。
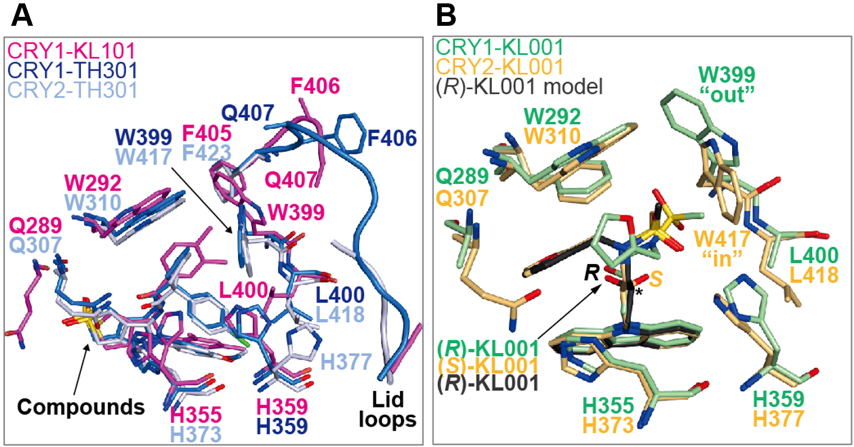
図2. CRY1およびCRY2と化合物の複合体の構造
さらに、ゲートキーパーとlid loopの相互作用を変化させることによって、ゲートキーパーの向きから化合物の選択性を変えることができないかと考えました。そこでlid loopに変異を導入し、KL101とTH301の選択性に与える影響を解析しました。 その結果、CRY1においてゲートキーパーと相互作用する「Q407」を「A」に置換した変異体(CRY1 Q407A)は、KL101に対する応答が低下してTH301応答が上昇し、CRY2と同様の選択性を示すことがわかりました(図3)。一方、CRY2においてゲートキーパーと相互作用する「F424」を、それと隣接する「F423」とあわせて「A」に置換した変異体(CRY2 F423A/F424A)では、KL101に対する応答が上昇してTH301応答が低下し、CRY1と同様の選択性を示しました。この化合物選択性の逆転は、CRY1とCRY2の間でC末端領域(CCT)を入れ替えた場合にも見られました。以上の結果から、ゲートキーパーとlid loopの相互作用によって化合物の選択性が決まり、CCTはそれを補助するのに必要であると考えられます。
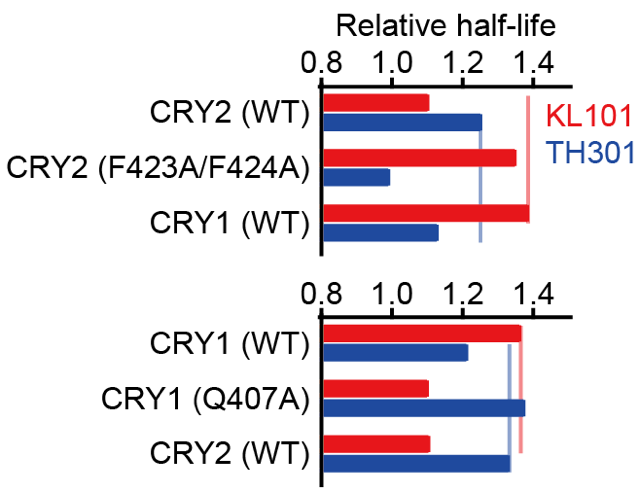
図3. 化合物の作用に対するCRY変異の影響
横軸はCRYタンパク質の半減期の相対値で、値が高いほど化合物の作用が強い
【今後の展望】
今回の研究では、結晶構造解析と分子動力学シミュレーション、および構造に基づく変異導入により、CRY1とCRY2で同一のアミノ酸が、ゲートキーパーとlid loopの間で異なる相互作用をすることによって化合物の選択性を生み出す、という知見を得ることに成功しました。アミノ酸配列を見ていただけではたどり着けなかった発見です。このメカニズムに対してCCTがどのように関与しているのか、今後のさらなる研究で、CRY1とCRY2の違いを生み出す分子機構の全貌が解明されるに違いありません。さらに、このユニークな仕組みに基づいて、CRY1とCRY2のそれぞれに対する選択性をより高めた化合物の開発が進むと期待されます。それらの化合物は、CRY1とCRY2の特異的な制御を可能にし、概日時計機構の理解だけでなく、CRY1やCRY2が関与する疾患の治療に向けた起点となるでしょう。
本研究は、文部科学省 世界トップレベル研究拠点プログラム 名古屋大学 トランスフォーマティブ生命分子研究所(WPI-ITbM※)、科学技術振興機構 戦略的創造研究推進事業さきがけ(JPMJPR14LA)、科学研究費助成事業 基盤研究(B)(18H02402)、基盤研究(A)(21H04766)、挑戦的研究(萌芽)(20K21269)、武田科学振興財団 ライフサイエンス研究継続助成、上原記念生命科学財団 研究奨励金、東京生化学研究会 研究助成金、日立財団 倉田奨励金などの支援のもとで行われたものです。
【用語説明】
注1)時計タンパク質:概日時計が働くために必要な遺伝子とタンパク質。哺乳類においてはCRY1、CRY2、PER1、PER2、CLOCK、BMAL1の6種類が知られている。これらの遺伝子やタンパク質の機能制御が概日時計の働きに重要な役割を果たすと考えられている。
注2)lid loop:CRYタンパク質の一部の名称。化合物が結合するポケットの近傍に存在する。
注3)ケミカルバイオロジー:化学の力を応用して生物学の謎に取り組む手法。
注4)X線結晶構造解析:結晶にX線を照射し、その回折像を見て分子の3次元構造を明らかにする手法。本研究ではSPring-8ならびに高エネルギー加速器研究機構の大型放射光施設を用いて実験を行った。
注5)分子動力学シミュレーション:一定時間における原子の動きと相互作用を解析するコンピューターシミュレーション。X線結晶構造がスナップショットであるのに対し、分子動力学シミュレーションでは動態を解析できる。
【論文情報】
雑誌名: Proceedings of the National Academy of Sciences
論文タイトル: Structural differences in the FAD-binding pockets and lid loops of mammalian CRY1 and CRY2 for isoform-selective regulation
著者: Simon Miller, Ashutosh Srivastava, Yoshiko Nagai, Yoshiki Aikawa, Florence Tama, and Tsuyoshi Hirota
論文公開日: 2021年6月28日
DOI: 10.1073/pnas.2026191118
2021-06-28

