研究ハイライト
低分子化合物で植物時計の仕組みを発見
名古屋大学トランスフォーマティブ生命分子研究所(ITbM)の中道範人准教授、大学院理学研究科の上原貴大博士課程修了生、水谷佳幸修士課程修了生、早稲田大学の山口潤一郎教授らの研究グループは、低分子化合物を使って植物時計に関わる新たなタンパク質とその働きを発見しました。
地球の自転に伴う昼夜変化に適応するために、多くの生物は遺伝的に組込まれた概日時計を獲得してきました。例えば「アレクサンドロス大王の東征時に記された葉の就眠運動」や「リンネの提唱した花時計」などは植物の時刻依存的な振る舞いを記載したものです。しかし、植物の概日時計のメカニズムの解明および産業的な利用の指針の確立は不十分です。その要因の1つとして、現存する多くの陸上植物は、染色体倍加のイベントを経ることで、体内に多くの推定重複遺伝子が存在しており、これが時計の基礎的な理解を妨げていると考えられています。今回、研究グループは推定重複遺伝子の存在をふまえた上で時計の仕組みを理解するために「化学・生物学の融合研究」を行いました。まず、未同定の時計機構の重要なステップを標的とする可能性をもつ低分子化合物をランダムスクリーニングによって見出しました。次に、分子プローブを用いたプロテオミクス解析によって化合物の標的タンパク質の探索を試み、シロイヌナズナのタンパク質リン酸化酵素であるカゼインキナーゼI (CK1)ファミリーを得ました。CK1をコードする遺伝子はシロイヌナズナには少なくとも13遺伝子座あり、これら遺伝子群の発現を一挙に低下させると化合物処理と同様の時計撹乱が認められました。さらに、CK1が作用する時計関連タンパク質も同定しました。
このように、本研究では活性のある低分子化合物の探索および分子プローブの活用により、これまで遺伝的重複性が要因となって隠されてきた時計のメカニズムを発見しました。これまで概日時計は、「バクテリア」、「動物」、「植物」などの生物界で独立して誕生したシナリオが支持されてきましたが、本研究の結果は従来の学説に一石を投じました。また、多くの穀物において、開花期の調節のために選抜された品種には、時計およびその制御下の遺伝子変異が頻出しています。したがって、今回の低分子化合物の発見により、将来的な地球環境変動に対する適応策の一環である花成時期調節を目指した低分子化合物の開発へ向けた取り組みが加速すると期待されます。
この研究成果は、令和元年5月14日付(日本時間4時)米国科学雑誌Proceeding of the National Academy of Sciencesオンライン版に掲載されました。
【ポイント】
■ 植物の1日の長さ(概日時計の周期長)を延長する低分子化合物を発見しました。
■ 分子プローブの設計とプロテオミクス解析により、周期延長化合物の標的タンパク質として遺伝的重複性が推測されるカゼインキナーゼ1(CK1)ファミリーを見出しました。また、周期延長化合物およびCK1の主要な作用経路を決定しました。
■ 植物の時計を標的とした分子は、花成時期の人為調節などの調整剤としての開発につながることを提案します。
■ 動植物に共通した時計関連タンパク質CK1の発見は、時計分子モデルの進化的シナリオに再考を促します。
【研究背景と内容】
概日時計は地球上の多くの生物に認められる約24時間の周期を創りだす遺伝的に組込まれたシステムです。植物は概日時計の働きにより、1日のうちで最適な時刻に適切な生理反応を行います。オジギソウの日周期的な就眠運動や、多くの植物の開花する時間などは良く知られた「時計に依存した」生理応答です。その他にも、突然の日光は光合成装置からの酸化ストレスの発生の原因となるため、植物はやがてやってくる朝に向けて酸化ストレスへの対応を夜のうちから準備し始めます。またやってくる夜の低温に向けて、午後のうちから低温への応答を始めます。このように、概日時計の働きによって植物は外環境の時刻変化へ予期的に応答することができます(図1)。また、多くの植物は特定の季節に花を咲かせますが、その現象の背景にある日長測定注1のための体内時間情報の基礎として概日時計は働いています。特定の季節に花芽を形成するための日長測定を、概日時計が生み出す体内時刻を基礎として使っています(図1)。時計機構の変異による花成時期の変化の事例が多くの植物種で報告されてきました。

概日時計は複数の時計関連タンパク質の相互の転写制御によって成り立つとされますが、その理解はまだ不完全でした。その理由の1つとして、多くの植物は染色体倍加注2の結果生じた遺伝的冗長性注2の高い遺伝子群を持ち、このような冗長性遺伝子群を踏まえて時計システムを理解する方法が限られていたからです。
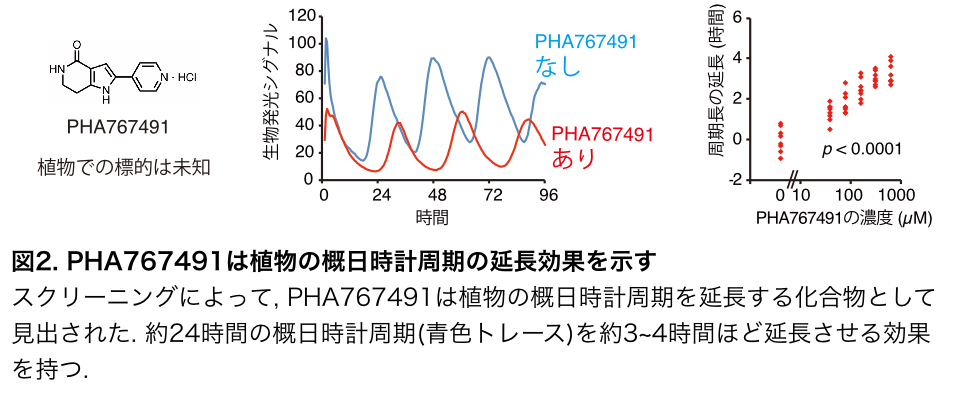
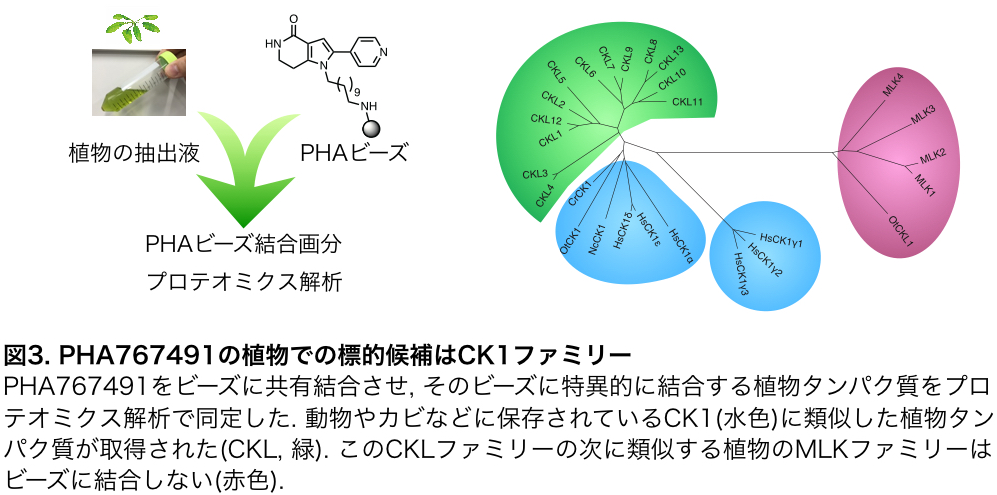
研究グループは、仮に、機能重複あるいは生存必須機能を持つタンパク質群に働きかける薬剤(化合物)があれば、上記の問題点を解決できると考えました。まず、トランスフォーマティブ生命分子研究所で整備された化合物ライブラリーからシロイヌナズナの概日時計周期を延長する化合物のスクリーニングを実施し、PHA767491という化合物を得ました(図2)。PHA767491は動物のCDK7(cyclin dependent kinase 7)の阻害剤として知られていましたが、植物における標的は不明でした。植物でのPHA767491の標的を探るため、PHA767491の活性をある程度保持したままアガロースビーズ注3に共有結合できる分子プローブ注3を開発して、これをPHAビーズ(図3)と命名しました。PHAビーズに結合するシロイヌナズナ由来のタンパク質を質量分析したところ、CK1タンパク質注4を見出しました。CK1タンパク質はシロイヌナズナには少なくとも13遺伝子座にコードされていました。この13のCK1遺伝子群の発現を一括的に低下させると概日リズム周期が延長したため、PHA767491はCK1を阻害することで時計周期長を調節することが示唆されました(図3)。
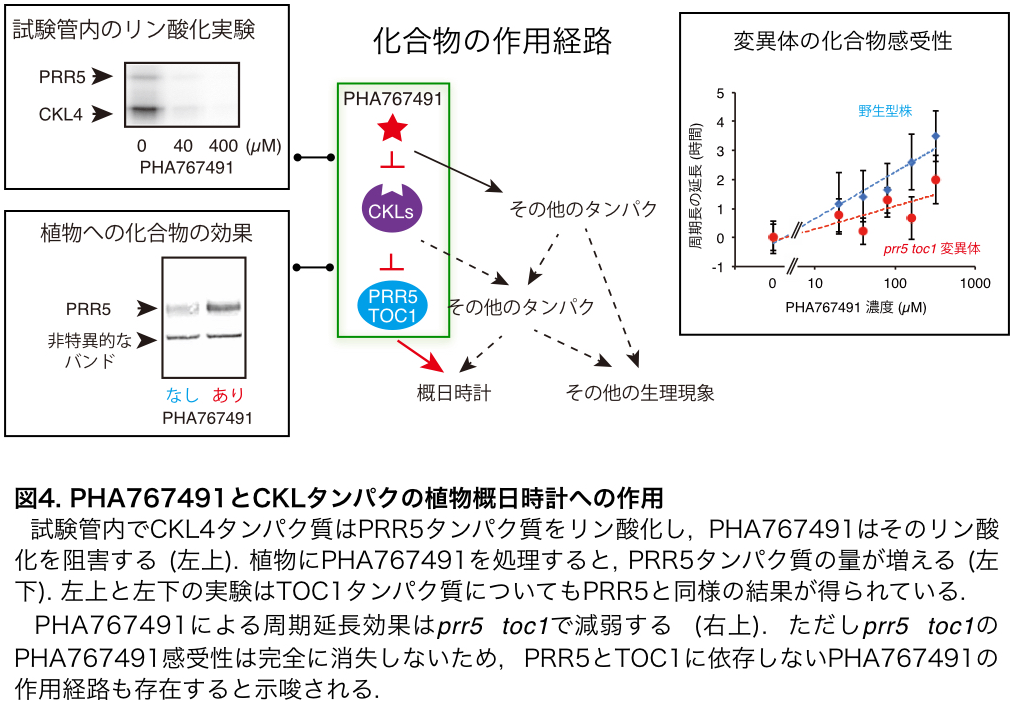
また、研究グループは、PHA767491の作用機序を探る別のアプローチとしてPHA767491を短時間処理した直後の遺伝子発現の変化に着目しました。PHA767491の効果として、明け方と朝の遺伝子群の発現が低下することが示されたため、この遺伝子群を直接的に制御することが知られていたPRRタンパク質群注5とCK1の関係が疑われました。実際に研究グループはCK1が試験管内でPRR5とTOC1をリン酸化すること、このリン酸化はPHA767491で阻害されることを見出しました。また、シロイヌナズナにPHA767491を投与するとPRR5とTOC1の分解が緩やかになりました。以上のことから、CK1はPRR5とTOC1の分解の契機となるリン酸化修飾を担っていると示唆されました(図4)。
【成果の意義】
本研究は、植物に活性のある低分子化合物の標的を分子プローブの利用により発見した初のケースになりました。また、多くの穀物で、時計およびその下流を標的とした品種が開花期の調節のために選抜されてきていることを踏まえると、今回の低分子化合物の発見により、将来的な地球環境変動に対する適応策の一環である花成時期調節を目指した低分子化合物の開発へ向けた取り組みを加速すると期待されます。従来の知見では、それぞれの生物界(バクテリア、カビ、動物、植物)で進化的に起源の異なるタンパク質が時計を作り出してきた、いわゆる「収斂的な進化シナリオ」注6が支持されてきましたが、CK1はカビと動物の時計の調節に関わることが知られていたため、今回の植物時計におけるCK1の時計への関わりの発見は、これまでの時計分子の進化シナリオに再考を促します。
今回の研究は、本学トランスフォーマティブ生命分子研究所の桑田啓子特任助教、廣田毅特任准教授、佐藤綾人特任准教授、大川(西脇)妙子准教授、吉村崇教授、Steve Kay教授、伊丹健一郎教授、木下俊則教授、東京大学の溝井順哉准教授と篠崎(山口)和子教授、中部大学の鈴木孝征准教授、京都大学の伊藤照悟助教らと共同で行われました。
論文情報:
雑誌名:Proceeding of the National Academy of Sciences
論文タイトル:Casein kinase 1 family regulates PRR5 and TOC1 in the Arabidopsis circadian clock
(シロイヌナズナの概日時計においてCasein kinase 1はPRR5とTOC1を制御する)
著者:Takahiro N Uehara、Yoshiyuki Mizutani、Keiko Kuwata、Tsuyoshi Hirota、Ayato Sato、Junya Mizoi、Saori Takao、Hiromi Matsuo、Takamasa Suzuki、Shogo Ito、Ami N Saito、Taeko Nishiwaki-Ohkawa、Kazuka Yamaguchi-Shinozaki、Takashi Yoshimura、Steve Kay、Kenichiro Itami、Toshinori Kinoshita、Junichiro Yamaguchi、Norihito Nakamichi (上原貴大*、水谷佳幸*、桑田啓子*、廣田毅*、佐藤綾人*、溝井順哉、高尾早織、松尾宏美*、鈴木孝征、伊藤照悟、斎藤杏実、大川(西脇)妙子*、篠崎(山口)和子、吉村崇*、Steve Kay*、伊丹健一郎*、木下俊則*、山口潤一郎、中道範人*) *名古屋大に所属
リンク:


関連記事・報道:
- 沖縄タイムスプラス 「低分子化合物で植物時計の仕組みを発見 」(2019.5.17 )
- zakzak by 夕刊フジ 「低分子化合物で植物時計の仕組みを発見 」(2019.5.17 )
- 福井新聞ONLINE 「低分子化合物で植物時計の仕組みを発見 」(2019.5.17 )
- デジタル毎日 「低分子化合物で植物時計の仕組みを発見 」(2019.5.17 )
- 宮崎日日新聞 「低分子化合物で植物時計の仕組みを発見 」(2019.5.17 )
- 朝日新聞 「生物時計のメカニズム研究」(2019.6.2 朝刊 22面)
2019-05-17

