Research

植物が生産する多種多様な低分子化合物の中には、自身の生理生長を調節する

トウモロコシ畑でピンク色の花を咲かせるストライガ
ケニアにて撮影 2019年7月
寄生植物は、私たちが普段よく見かける植物とは異なり、他の植物に寄生して栄養を奪って生きる植物です。これまで知られている植物種の1%に相当する4,000種もの寄生植物が発見され、その中には、世界最大の花をつけるラフレシアや、お香の原料となる白檀、さらにヤドリギやナンバンギセルといった日本国内で自生しているものも多数あります。こういった寄生植物の大半は野生での競争力も低く人畜無害ですが、中には人の営みに適応して大きく繁殖し、深刻な社会問題を起こしているものも含まれます。特に、「魔女の雑草」として恐れられる
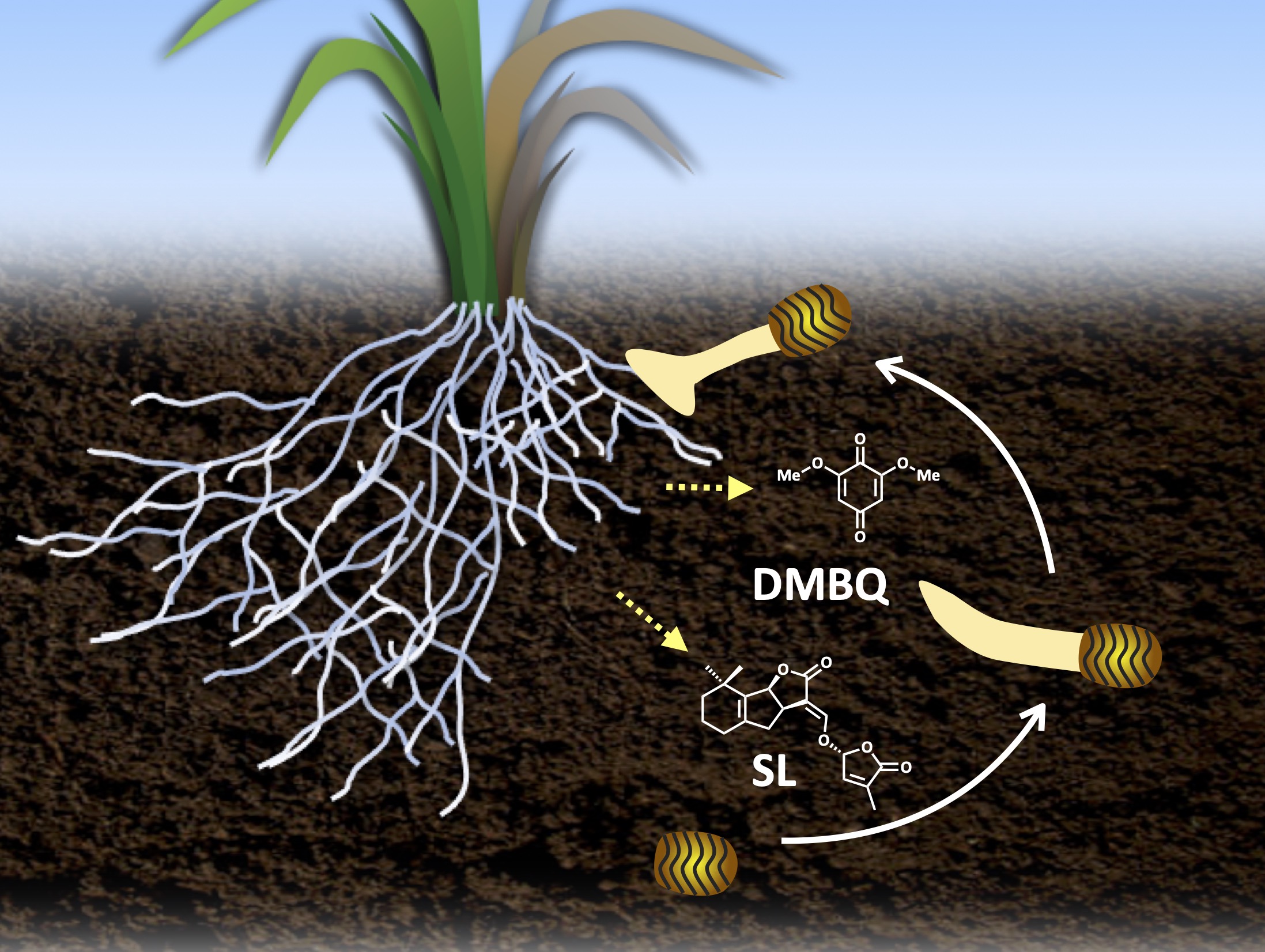
宿主植物が放出するシグナル分子への応答
寄生植物の生活環は、宿主植物との情報交換を含む複雑なものです。ストライガの場合、土中に埋まっている種子は発芽することなく、宿主植物が近くで育ち始めるのを20年以上待ち続けることができます。宿主が近くで生育を始めると、その根から土の中へと放出される
私たちのグループでは、どのような生物にでも適用できる低分子ツールを主軸に、寄生植物やその近傍で起こる生命現象の解明を目指して研究を行なっています。「なぜ植物が寄生するのだろうか?」「どうやって植物が寄生する能力を獲得したのだろう?」など、寄生植物はユニークな疑問を投げかける植物であり、こういった謎を解明することは、アフリカの食糧問題のような地球規模の課題の解決にもつながるだろうと考えられます。寄生植物の奇妙な生態への興味を起点に、シグナル分子が紡ぐバイオロジーの新たな側面を開拓し、人類へ貢献していきたいと考えています。
これまでの研究の概要
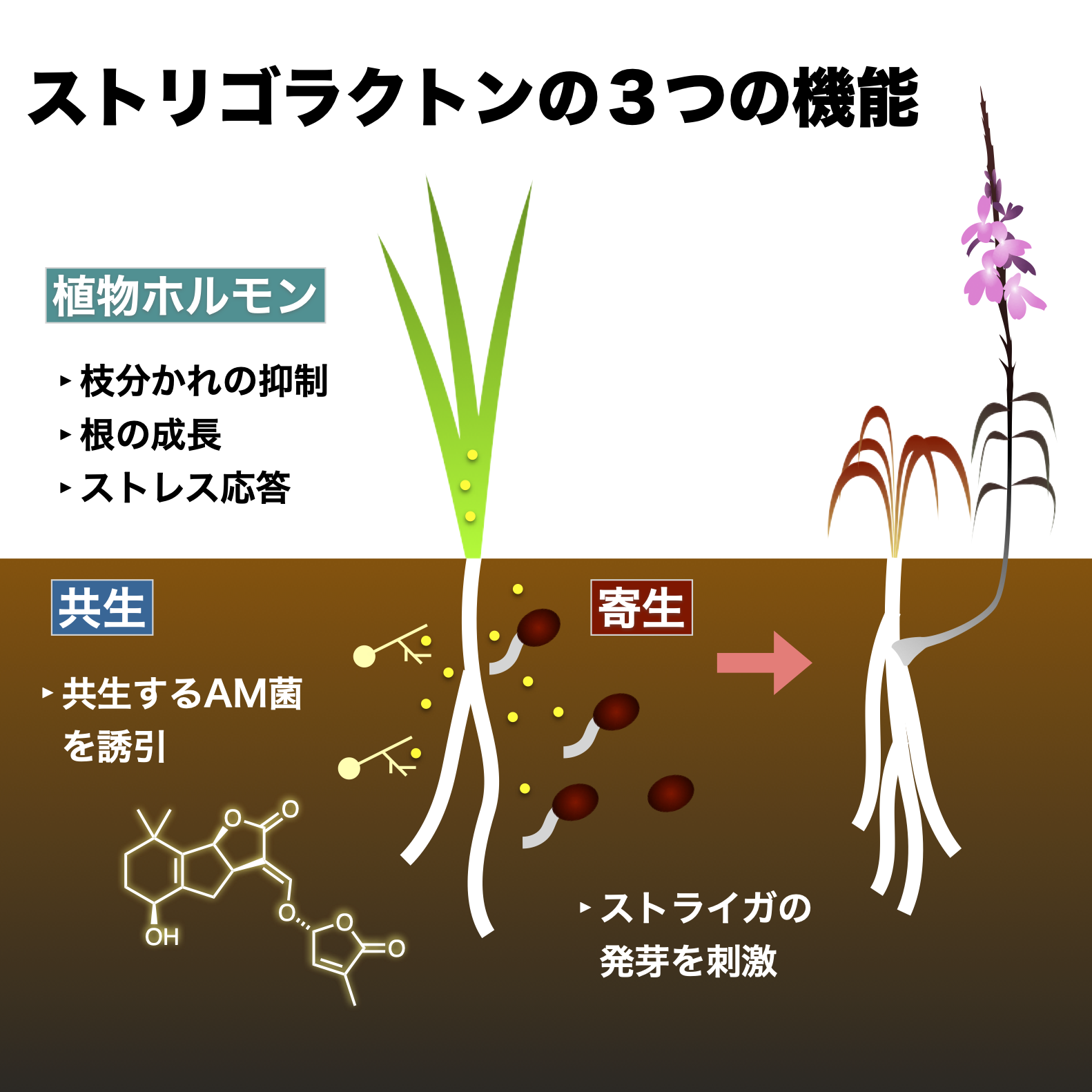 ストリゴラクトン
ストリゴラクトン
SLは、1966年にストライガの発芽を刺激する宿主因子として初めて同定され (Cook et al., Science)、2005年に菌根菌との共生シグナルとして (Akiyama et al., Nature)、また2008年には植物ホルモンとして三たび発見されたシグナル分子である (Gomes-Roldan et al., Nature; Umehara et al., Nature)。ストライガの防除の観点からの研究はもっとも長く続けられてきており、特に単独では生育できない寄生植物の性質を利用し、宿主のいないところで強制的に発芽させ枯死に導く自殺発芽剤として、人工SLの開発が精力的に行われてきた。一方、ストライガでは形質転換や変異株の取得といった遺伝学的な解析を行うことができないため、ストライガがどのようにSLを感知し、発芽を起こすかについては全く分かっていなかった。そこで、まずはストライガが発芽する機構を解明し、それをストライガの防除策の開発へと応用する方針で研究を進めてきた。
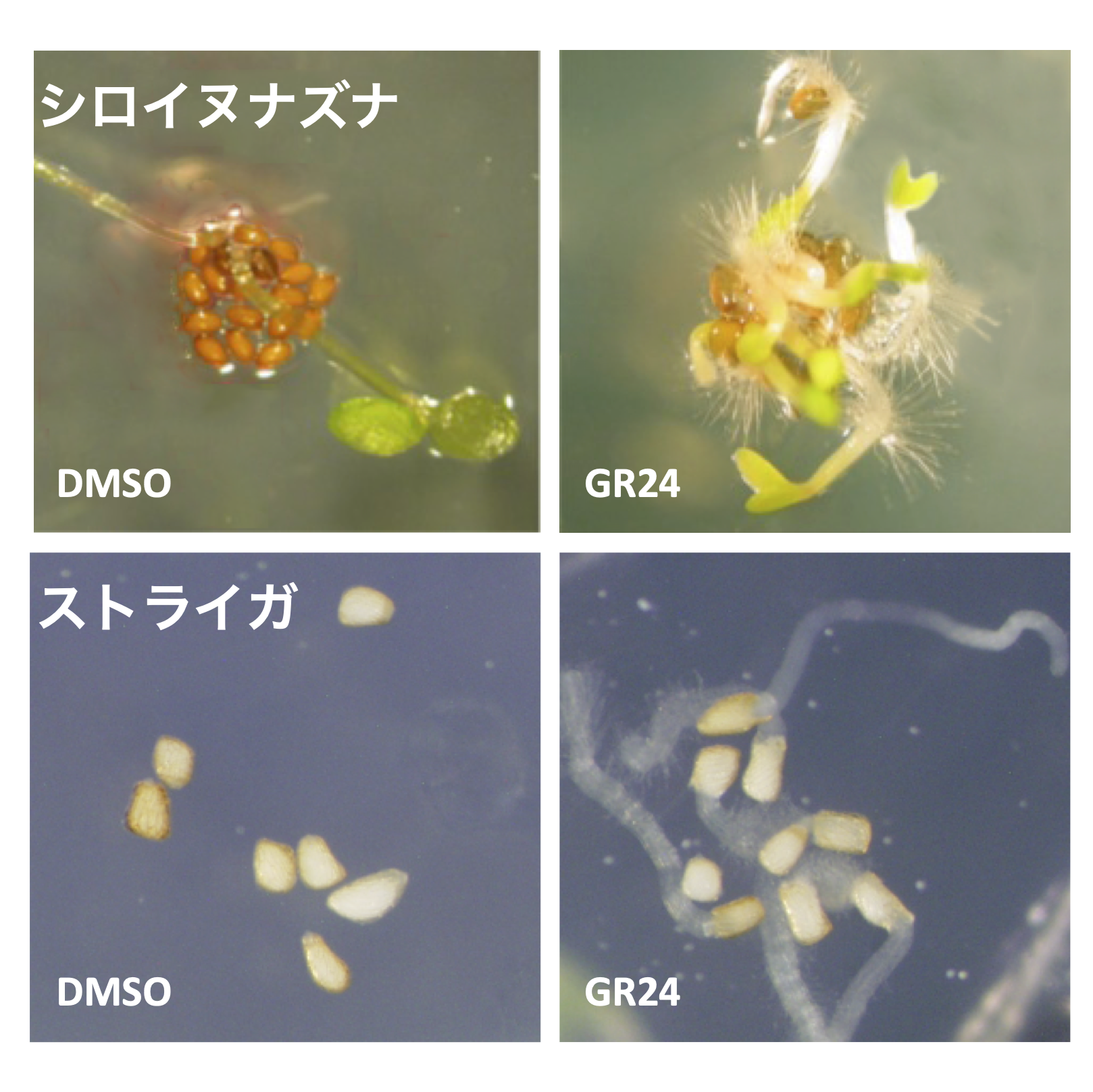 研究開始当初は通常の植物の種子発芽の研究を行なっていたが、当時は黎明期だったケミカルスクリーニングを用いた研究より、寄生植物が引き起こす問題を知るに至った。当初、アブシジン酸とジベレリンが表皮と内部組織を往来するプロセスを介して発芽を起こす機構の解明を目指して
研究開始当初は通常の植物の種子発芽の研究を行なっていたが、当時は黎明期だったケミカルスクリーニングを用いた研究より、寄生植物が引き起こす問題を知るに至った。当初、アブシジン酸とジベレリンが表皮と内部組織を往来するプロセスを介して発芽を起こす機構の解明を目指して
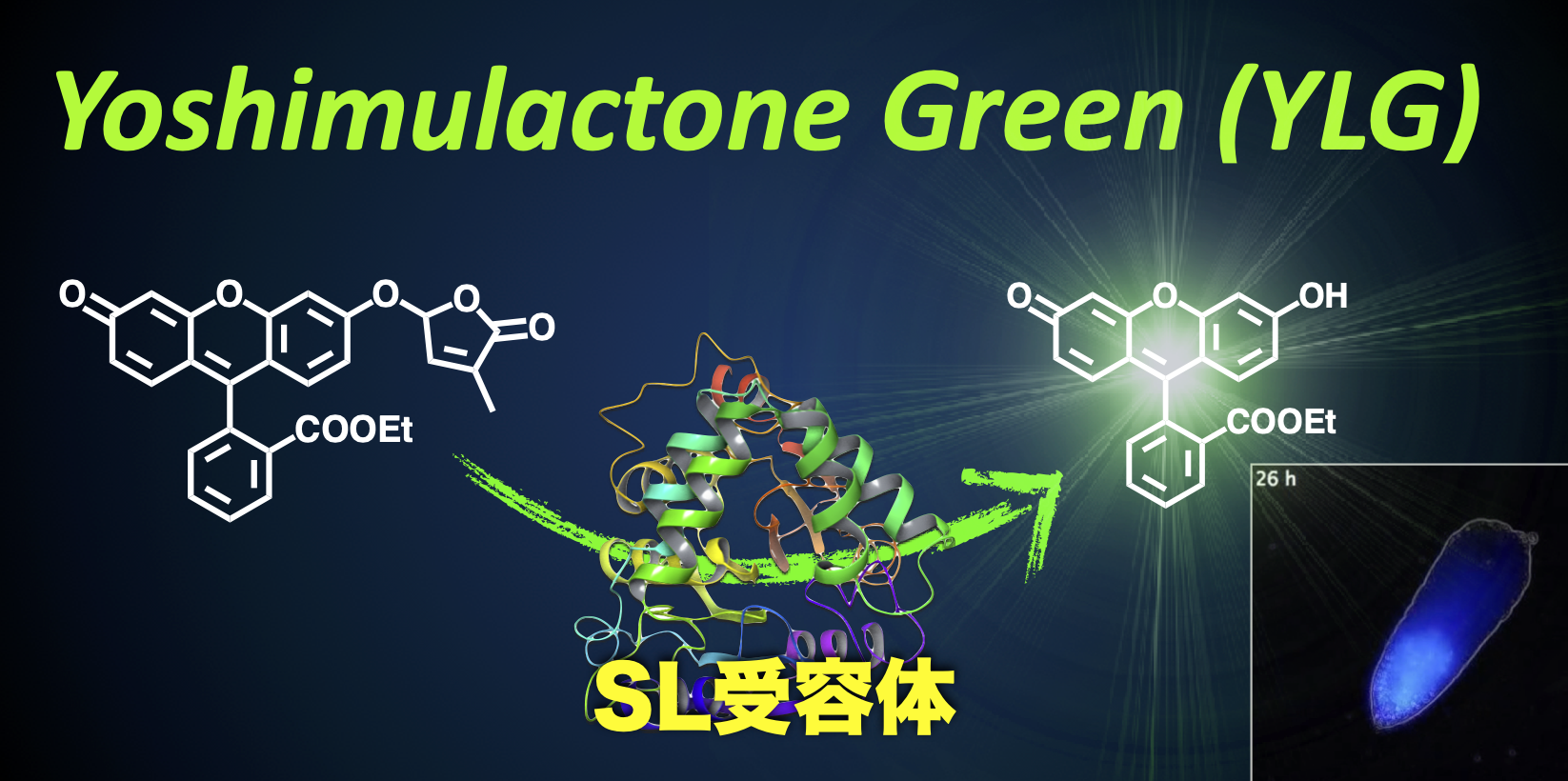 「切れたら光るSL」をコンセプトに化学者との共同で開発したヨシムラクトングリーン(YLG)を活用することで、in vitro でのSL受容体とリガンドの結合測定や、ストライガの種子中でのSL受容体の働きを観察することが可能となった。このYLGを使ったアッセイ系を活用することで、シロイヌナズナを用いた研究をもとに発見した11個のShHTLファミリータンパク質がストライガにおけるSL受容体であることの証明し
「切れたら光るSL」をコンセプトに化学者との共同で開発したヨシムラクトングリーン(YLG)を活用することで、in vitro でのSL受容体とリガンドの結合測定や、ストライガの種子中でのSL受容体の働きを観察することが可能となった。このYLGを使ったアッセイ系を活用することで、シロイヌナズナを用いた研究をもとに発見した11個のShHTLファミリータンパク質がストライガにおけるSL受容体であることの証明し
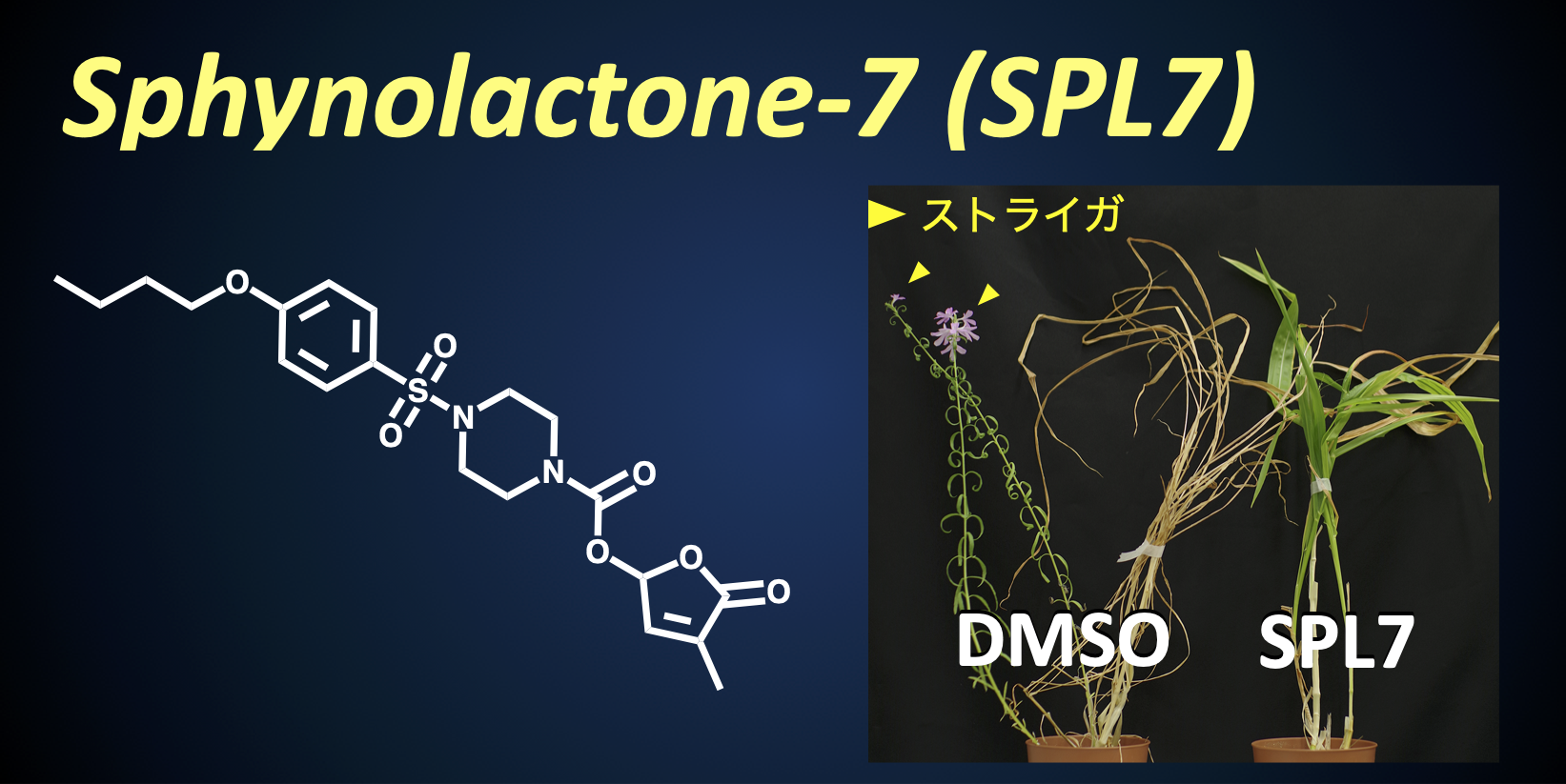 これら情報・アッセイ系とケミカルスクリーニングを併用することで、受容体機能を指標とした自殺発芽剤の開発を進め、人工骨格と天然ストリゴラクトンの活性部位を連結させたハイブリッド分子であるスフィノラクトン-7(SPL7)の開発に成功した
これら情報・アッセイ系とケミカルスクリーニングを併用することで、受容体機能を指標とした自殺発芽剤の開発を進め、人工骨格と天然ストリゴラクトンの活性部位を連結させたハイブリッド分子であるスフィノラクトン-7(SPL7)の開発に成功した
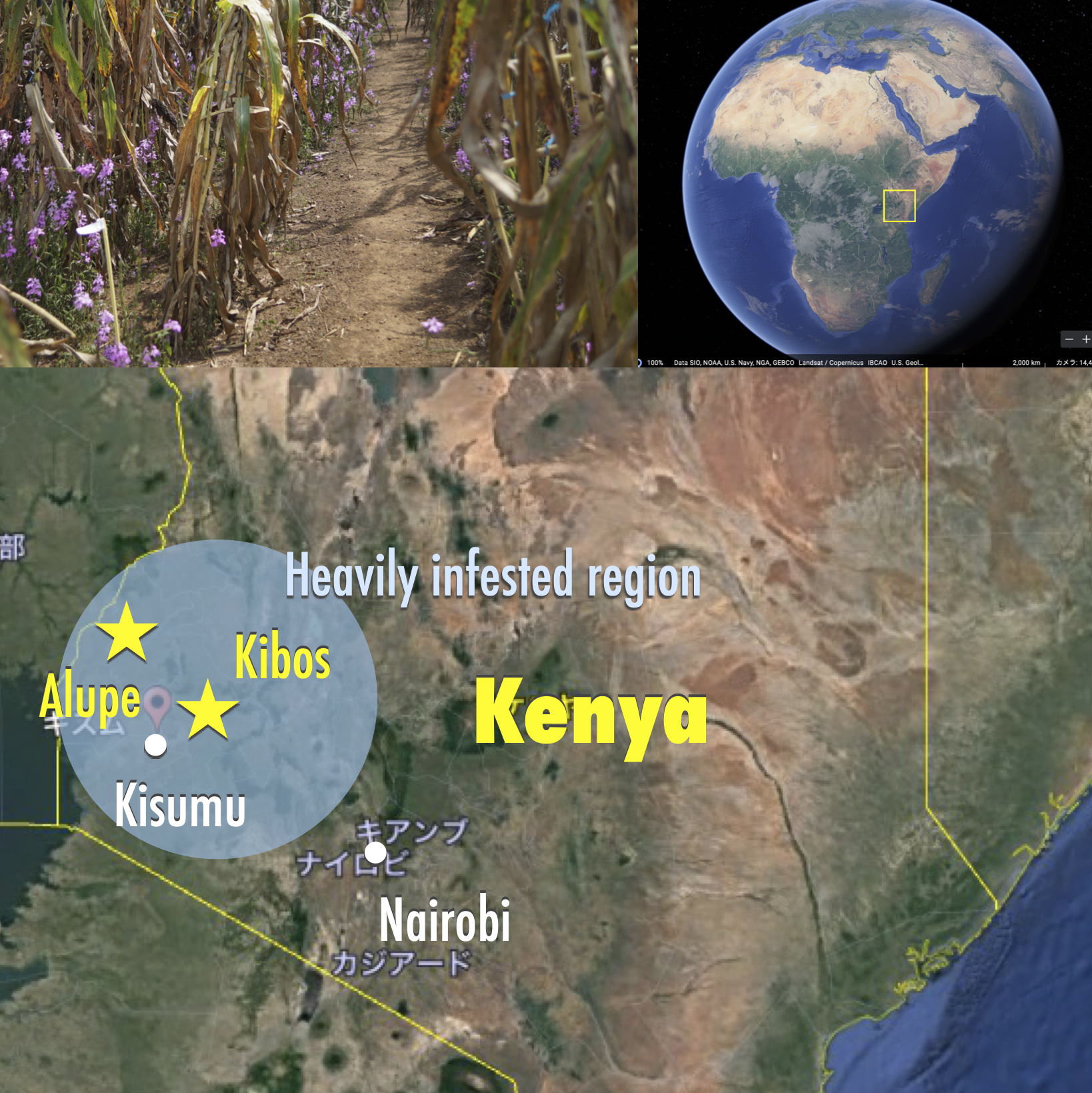 自殺発芽剤として実用する上で、SLの多様な機能は生態や環境への負荷にもなりうる。SPL7は、フェムトモーラーレベル(琵琶湖の水量に小さじ一杯程度)で発芽刺激する驚異的な活性を持つにも関わらず、ストライガに対する強い選択性を併せ持つため、理想的な自殺発芽剤としてアフリカの食糧増産に貢献することが期待される。これを実現するため、ストライガに大きな被害を受けるケニアでの現地実証試験を現在進めている。学内外の協力のもと、ケニア農畜産研究機構 (KALRO) との共同研究にて、ビクトリア湖岸に位置するKibos支所での圃場試験を2018年より開始した。現在、少なくともポット試験レベルでは、SPL7は現地の気候・土壌環境においてもストライガの自殺発芽を誘導することを確認している(詳細はこちらから)。
自殺発芽剤として実用する上で、SLの多様な機能は生態や環境への負荷にもなりうる。SPL7は、フェムトモーラーレベル(琵琶湖の水量に小さじ一杯程度)で発芽刺激する驚異的な活性を持つにも関わらず、ストライガに対する強い選択性を併せ持つため、理想的な自殺発芽剤としてアフリカの食糧増産に貢献することが期待される。これを実現するため、ストライガに大きな被害を受けるケニアでの現地実証試験を現在進めている。学内外の協力のもと、ケニア農畜産研究機構 (KALRO) との共同研究にて、ビクトリア湖岸に位置するKibos支所での圃場試験を2018年より開始した。現在、少なくともポット試験レベルでは、SPL7は現地の気候・土壌環境においてもストライガの自殺発芽を誘導することを確認している(詳細はこちらから)。
これまで生物学・化学・計算科学の融合研究によって創出ししてきたYLGや受容体アイソフォーム選択的アゴニスト・アンタゴニスト
Reference
- Gazzarrini et al. (2004) The Transcription Factor FUSCA3 Controls Developmental Timing in Arabidopsis through the Hormones Gibberellin and Abscisic Acid. Dev. Cell, 7, 373–385, 2004. doi:10.1016/j.devcel.2004.06.017
- Tsuchiya et al. (2004) The FUS3 transcription factor functions through the epidermal regulator TTG1 during embryogenesis in Arabidopsis. Plant J. 37, 73–81, 2004. doi:10.1046/j.1365-313X.2003.01939.x
- Tsuchiya et al. (2010) A small-molecule screen identifies new functions for the plant hormone strigolactone. Nat. Chem. Biol., 6, 741–749, 2010. doi:10.1038/nchembio.435
- Toh et al. (2012) Thermoinhibition Uncovers a Role for Strigolactones in Arabidopsis Seed Germination. Plant Cell Physiol., 53, 107–117, 2012. doi:10.1093/pcp/pcr176
- Toh et al. (2014) Detection of parasitic plant suicide germination compounds using a high-throughput Arabidopsis HTL/KAI2 strigolactone perception system. Chem. Biol., 21, 988–998, 2014. doi:10.1016/j.chembiol.2014.07.005
- Tsuchiya et al. (2015) Probing strigolactone receptors in Striga hermonthica with fluorescence. Science, 349, 864–868, 2015. doi:10.1126/science.aab3831
- Toh et al. (2015) Structure-function analysis identifies highly sensitive strigolactone receptors in Striga. Science, 350, 203–208, 2015. doi:10.1126/science.aac9476
- Uraguchi et al. (2018) A femtomolar-range suicide germination stimulant for the parasitic plant Striga hermonthica. Science, 362, 1301–1305, 2018. doi:10.1126/science.aau5445
- Yoshimura et al. (2018) Discovery of Shoot Branching Regulator Targeting Strigolactone Receptor DWARF14. ACS Cent. Sci., 4, 230–234, 2018. doi:10.1021/acscentsci.7b00554
- Holbrook-Smith et al. (2016) Small-molecule antagonists of germination of the parasitic plant Striga hermonthica. Nat. Chem. Biol., 12, 724–729, 2016. doi:10.1038/nchembio.2129


















