生きた細胞内で脂肪酸の代謝産物を3色で染め分け ~脂質代謝を標的とした細胞機能解明と創薬へ~
国立大学法人東海国立大学機構 名古屋大学トランスフォーマティブ生命分子研究所(WPI-ITbM※)の多喜 正泰 特任准教授、山口 茂弘 教授らの研究グループは、ミュンスター大学(ドイツ)のフランク・グロリアス教授との共同研究で、生きた細胞内で脂肪酸の代謝産物を染め分けることができる新たな技術を開発しました。
細胞内に取り込まれた脂肪酸は、様々な代謝過程を経由して細胞小器官(オルガネラ)に分布され、リン脂質合成やエネルギー産生などに利用されます。脂肪酸代謝は生命維持活動と直結しており、代謝機能の異常と肥満・がん・肝炎などの多様な疾病との関連性も明らかになっています。蛍光イメージング法は細胞内の脂肪酸代謝を観察するうえで有効な手法ですが、代謝された脂肪酸がどのオルガネラにどの程度存在し、どのように利用されているのかを評価することは困難でした。
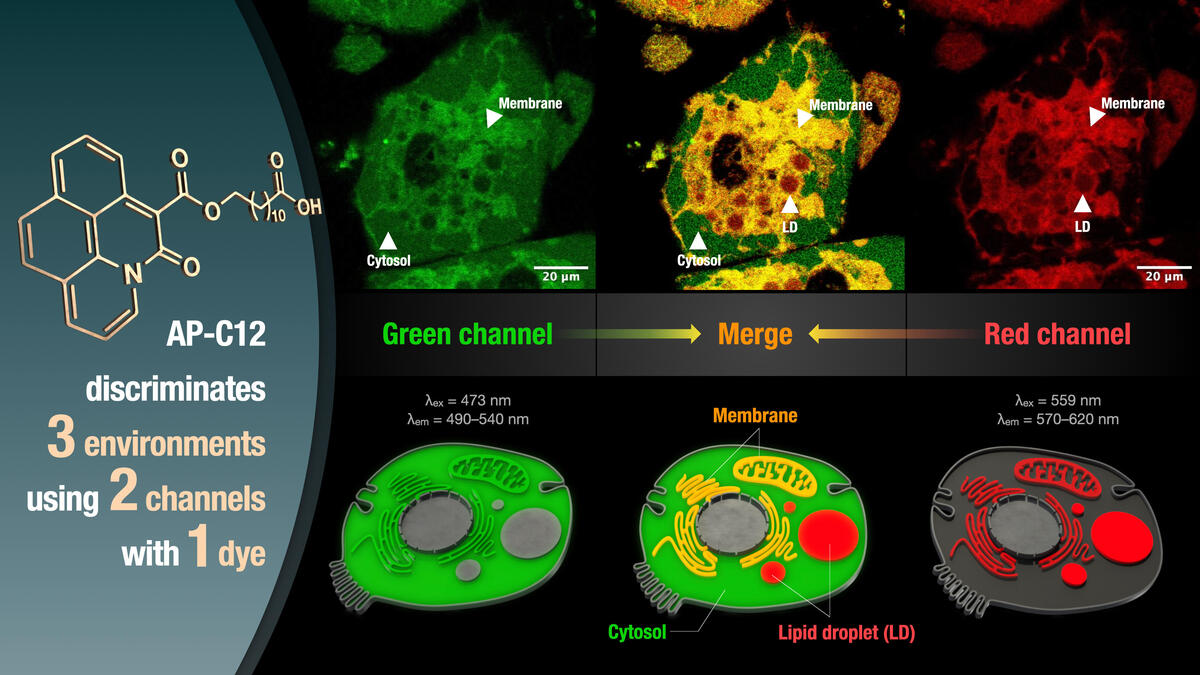
本研究では、周囲の極性環境に応じて蛍光特性が変化する蛍光色素に着目し、これを長鎖脂肪酸の末端に連結させた蛍光性の脂肪酸誘導体「AP-C12」を開発しました。この分子を細胞に添加すると、「AP-C12」の代謝産物が様々なオルガネラに分布し、さらにはオルガネラの局所的な極性環境に応答して蛍光スペクトルが変化することがわかりました。その性質を生かし、異なる励起・検出波長のセットを用いることにより、代謝産物の細胞内分布を細胞質基質、膜組織、脂肪滴に分けて蛍光色の違いとして可視化することに成功しました。脂質代謝の研究や、代謝経路を標的とした創薬への応用などが期待されます。
本研究成果は、2022年5月9日付イギリス科学誌「Nature Communications」オンライン版に掲載されました。
【ポイント】
・細胞内での脂肪酸代謝産物の分布を可視化、および分析するための方法論が求められていた。
・周囲の環境によって蛍光特性が変化する蛍光色素を連結した脂肪酸誘導体AP-C12を開発し、脂肪酸代謝産物の細胞内分布を色の違いとして可視化・分析することに成功した。
・細胞の栄養飢餓状態において、ミトコンドリアへの脂肪酸供給はリポリシスが優先して進行していることが示唆された。
・本手法は、脂肪酸代謝が関与する生命科学研究や創薬における強力なツールとなることが期待される。
【研究背景と内容】
細胞内に取り込まれた脂肪酸は、細胞小器官(オルガネラ)における連鎖的な酵素反応によって代謝され、リン脂質合成やエネルギー産生に利用されます。脂肪酸の代謝は、生命維持活動の根幹を担っていることに加え、脂肪酸の代謝過程の異常が肥満や糖尿病、ガンなど多くの疾病と深く関与していることから、医学および細胞生物学的研究が盛んに行われてきました。
リアルタイムかつ高い時空間分解能で細胞機能を観察できる蛍光イメージング法は、脂肪酸代謝研究において強力な技術です。蛍光イメージングで脂肪酸代謝を可視化するためには、蛍光色素が連結した脂肪酸(蛍光脂肪酸)が必要です。しかし、従来の蛍光脂肪酸には2つの大きな問題点がありました。1つは、脂肪酸代謝産物の可視化です。代謝産物は様々なオルガネラに分布していますが、細胞内分布を蛍光で分析するためには、各種オルガネラを別途蛍光標識しておく必要があり、効率的とはいえません。もう1つは蛍光脂肪酸の代謝効率です。脂肪酸は様々な酵素によって代謝されますが、蛍光色素の影響によって脂肪酸代謝が進行しにくくなる場合があります。細胞内に取り込まれた脂肪酸の代謝産物が、どのオルガネラにどの程度存在し、細胞の生命維持活動においてどのように利用されているのかを明らかにするためには、上記2つの課題を克服した新たな蛍光脂肪酸の開発が求められていました。
共同研究チームはこれまでに、蛍光色素アザピレン「AP-Me」(図1a)を報告しました(F.Glorius et al., Angew. Chem. Int. Ed. 2015, 54, 4508)。今回、共同研究チームはAP-Meは分子サイズが小さいことに加え、蛍光特性が溶媒の極性に応答して変化する環境応答性注1)を示すことに着目し(図1b)、末端にアザピレン注2)部位を有する長鎖脂肪酸AP-C12(図1c)を開発しました。
AP-C12を細胞に添加したところ、様々なオルガネラに分布される様子が蛍光イメージングにより観察されました。細胞内におけるAP-C12代謝物の蛍光スペクトルを取得したところ、オルガネラにおける局所的な極性環境の違いに応答して蛍光スペクトルが変化することを見出しました(図2)。そこで共同研究チームは、2組の励起・検出波長のセット(緑チャンネルと赤チャンネル)を設定することで代謝産物の分布を染め分けできると考えました。緑チャンネルでは、高極性の細胞質や中極性の膜組織注3)が検出されるのに対し、赤チャンネルでは、膜組織と低極性の脂肪滴注4)が検出されます。したがって、これら2つのチャンネルで得られる画像を重ね合わせると、両チャンネルで観察される膜組織を識別することができ、その結果、1つの蛍光色素で異なる3つの環境に存在する脂肪酸代謝産物を検出することが可能になりました(図3)。
次に共同研究チームは、脂肪酸代謝過程を阻害する様々な薬剤を添加し、AP-C12の代謝産物の分布を可視化・分析することで、阻害剤の効果をパターン化することに成功しました(図4)。また、栄養飢餓状態にある細胞では、脂肪滴が分解して生じた脂肪酸がミトコンドリアへと供給されますが、肝臓ガン由来の細胞株であるHepG2細胞では、オートファジーによる脂肪分解(リポファジー注5))よりもリパーゼによる脂肪滴の加水分解反応(リポリシス)が優先的に進行していることを明らかにしました(図5)。これらは従来の蛍光脂肪酸では達成できなかった分析法であり、AP-C12の脂肪酸代謝研究における有用性を強く示すものです。
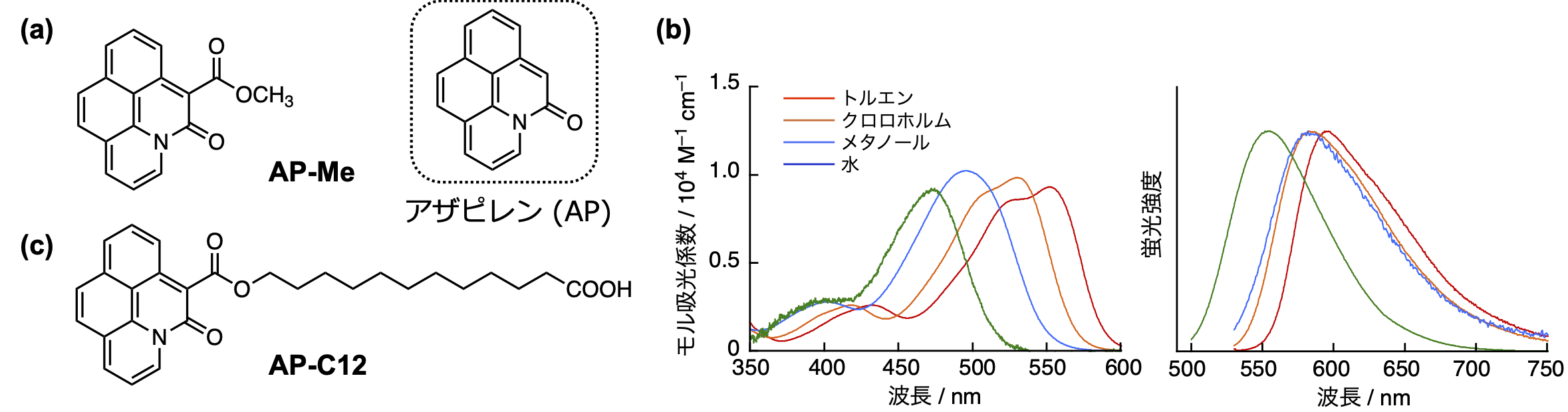
図1.アザピレン色素の構造と光物性。(a)AP-Meの構造。(b) 各溶媒中におけるAP-Meの吸収(左)および蛍光(右)スペクトル。(c)蛍光脂肪酸AP-C12の構造。
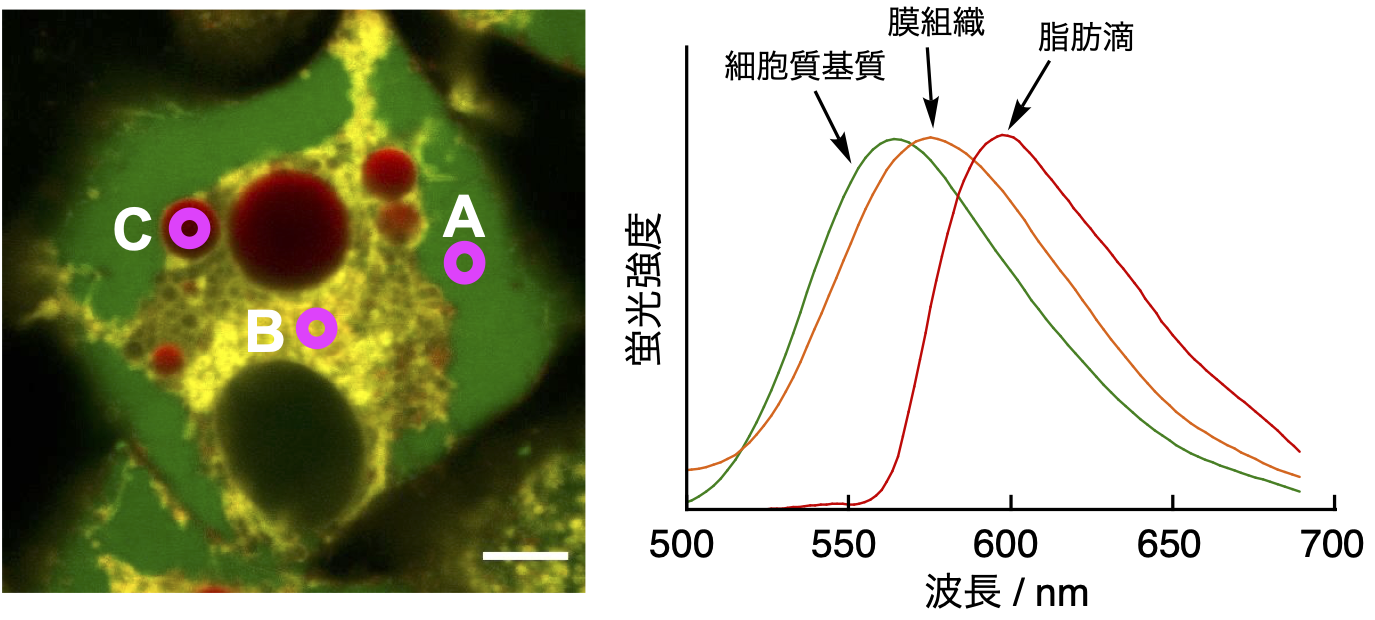
図2.AP-C12で処理した脂肪細胞(3T3-L1細胞から分化誘導)のスペクトルイメージング画像。A: 細胞質基質(緑)、B: 膜組織(黄色)、C: 脂肪滴(赤)に分布されたAP-C12の代謝物はそれぞれ異なる蛍光スペクトルを示す(右図)。
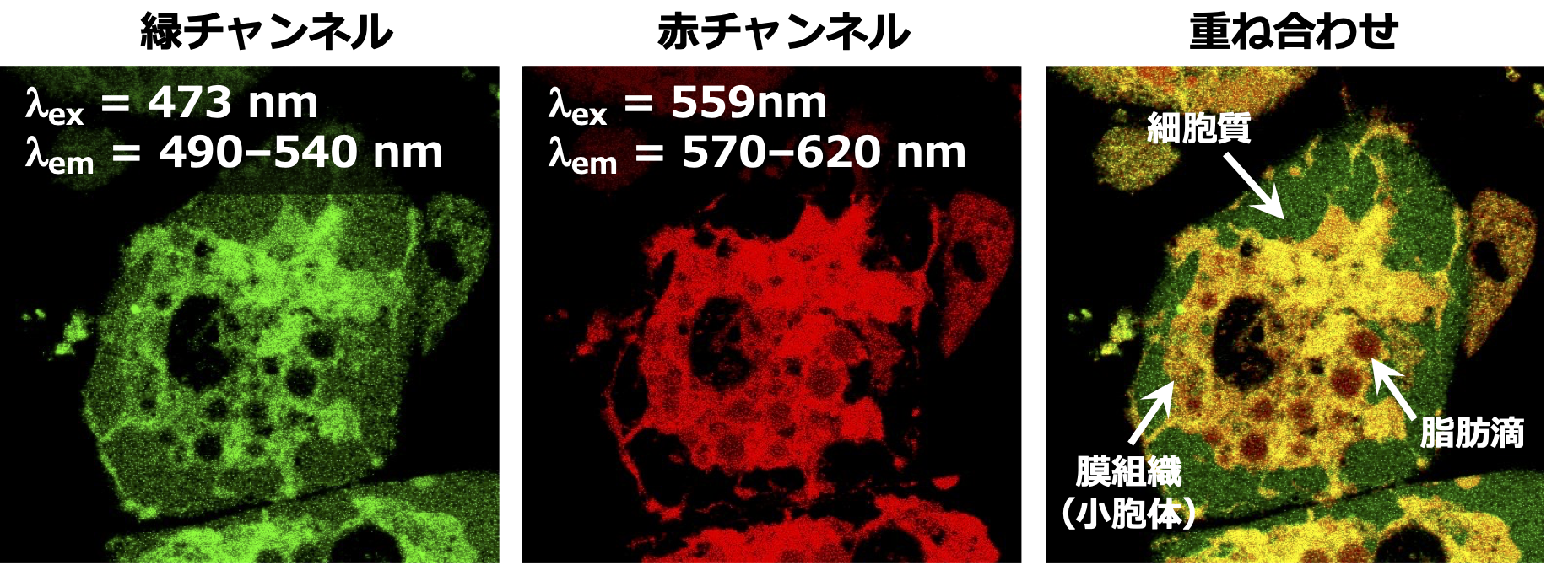
図3.緑チャンネル(473 nmで励起、490~540 nmで検出)と赤チャンネル(559 nmで励起、570~620 nmで検出)で取得した蛍光画像。両者を重ね合わせることにより、図2と同じように3つの環境を染め分けることができる。
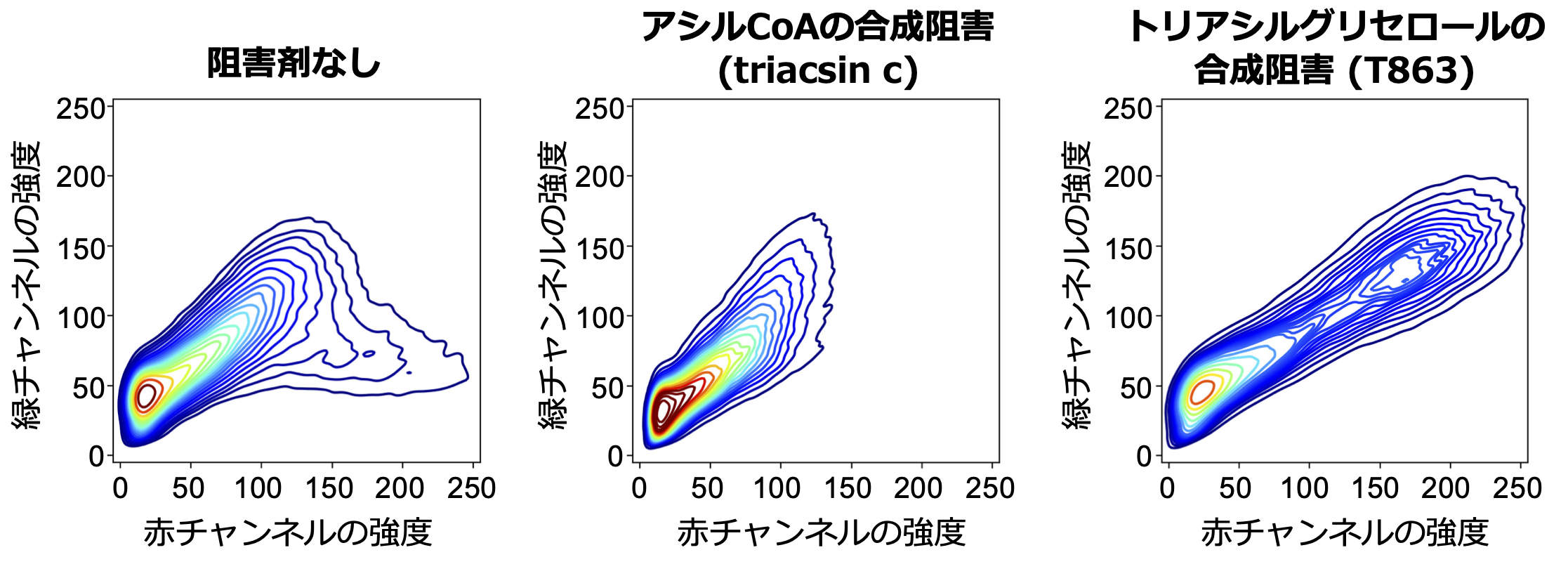
図4.脂質代謝阻害剤の効果をパターン化した例。HepG2細胞(肝臓ガン由来の細胞株)に各阻害剤で処理し、得られるAP-C12のシグナルを等高線で表記したもの。アシルCoAの合成阻害剤であるtriacsin cで処理した場合には、未処理のもの(左図)に比べて全体的な蛍光強度が低くなっており、AP-C12の代謝効率が低いことがわかる(中央図)。一方、トリアシルグリセロールの合成阻害剤であるT863で処理した場合は、ジアシルグリセロールが小胞体に蓄積するため、緑と赤の両方のチャンネルで強い蛍光が観察される(右図)。
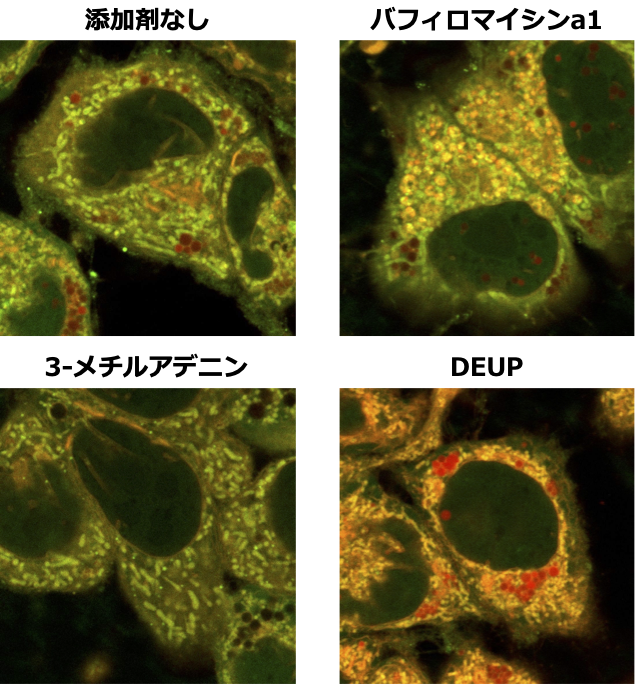
図5.栄養飢餓状態のHepG2細胞における脂肪滴分解過程の分析、オートファゴソームとリソソームの融合阻害剤であるバフィロマイシンa1を添加すると、多数の小胞が観察される(右上図)。またオートファジー阻害剤である3-メチルアデニンを添加しても脂肪滴の分解は抑制されない(左下図)。一方、リパーゼ阻害剤であるDEUPを添加した場合は、脂肪滴の加水分解反応が抑制され、赤チャンネルの蛍光シグナルが大幅に増大する(右下図)。
【成果の意義】
今回開発したAP-C12は、蛍光イメージングにおいて2つのチャンネルを用いることにより、3種類の脂肪酸代謝産物の識別を可能にします。本手法によって、脂肪酸の代謝経路を可視化・分析できるようになることから、脂質代謝が関与する細胞機能研究や脂肪酸代謝を標的とした創薬に繋がることが期待されます。
本研究は、文部科学省 世界トップレベル研究拠点プログラム 名古屋大学 トランスフォーマティブ生命分子研究所(WPI-ITbM※)、科学技術振興機構 戦略的創造研究推進事業さきがけ(JPMJPR16F5)、科学研究費助成事業 基盤研究(B)(19H02849)、 新学術領域研究 先端バイオイメージング支援プラットフォーム(ABiS)(JP16H06280)などの支援のもとで行われたものです。
【用語説明】
注1)環境応答性:
溶媒の極性が高くなるにつれて吸収・蛍光波長が長波長側にシフトするものを正のソルバトクロミズム、短波長側にシフトするものを負のソルバトクロミズムという。本研究の色素は負のソルバトクロミズム特性を示す。
注2)アザピレン:
3a-アザピレン-4-オン。窒素を含んだピレン様の蛍光色素骨格。
注3)膜組織:
リン脂質やコレステロールを主成分とするオルガネラ膜。小胞体膜にはトリアシルグリセロールの前駆体であるジアシルグリセロールも含まれる。ジアシルグリセロールは各種リン脂質の生合成にも利用される。
注4)脂肪滴:
中性脂肪であるトリアシルグリセロールやコレステロールエステルがリン脂質の一重膜で被われたオルガネラ。余剰な脂質の貯蔵庫として機能する他、エネルギー産生や膜形成を制御する役割も有する。
注5)リポファジー:
オートファジーの1種であり、脂肪滴を分解して遊離脂肪酸の生成を促進する。
Information
| 論文タイトル | A negative-solvatochromic fluorescent probe for visualizing intracellular distributions of fatty acid metabolites |
|---|---|
| 著者 | Keiji Kajiwara, Hiroshi Osaki, Steffen Greßies, Keiko Kuwata, Ju Hyun Kim, Tobias Gensch, Yoshikatsu Sato, Frank Glorius*, Shigehiro Yamaguchi*, Masayasu Taki* |
| 雑誌名 | Nature Communications |
| DOI | 10.1038/s41467-022-30153-6 |
