植物の気孔の幹細胞をゲノムレベルで制御する仕組みを解明 〜2つの異なるDNA配列と転写因子による気孔系譜細胞の発生運命の確定〜
【ポイント】
・植物の気孔の幹細胞が、幹細胞状態から分化状態へ切り換わる仕組みを解明した
・発生過程のゲノムの状態を調べ、気孔の幹細胞状態と関連する2つの異なるDNA配列を同定した
・この2つの配列と転写因子のMUTE注1)とBPC注2)が協調して、気孔の幹細胞遺伝子領域のゲノムの状態を物理的に変化させ、気孔の分化へと発生運命を確定させることが分かった
【研究概要】
国立大学法人東海国立大学機構 名古屋大学トランスフォーマティブ生命分子研究所(WPI-ITbM)の鳥居 啓子 主任研究者/客員教授(アメリカテキサス大学オースティン校 教授)と名古屋大学高等研究院のスンキ ハンYLC特任助教(研究当時)らの研究グループは、植物の気孔の発生過程におけるクロマチン注3)の動態を解析し、気孔の幹細胞が分化へ切り換わる仕組みの大枠を解明しました。
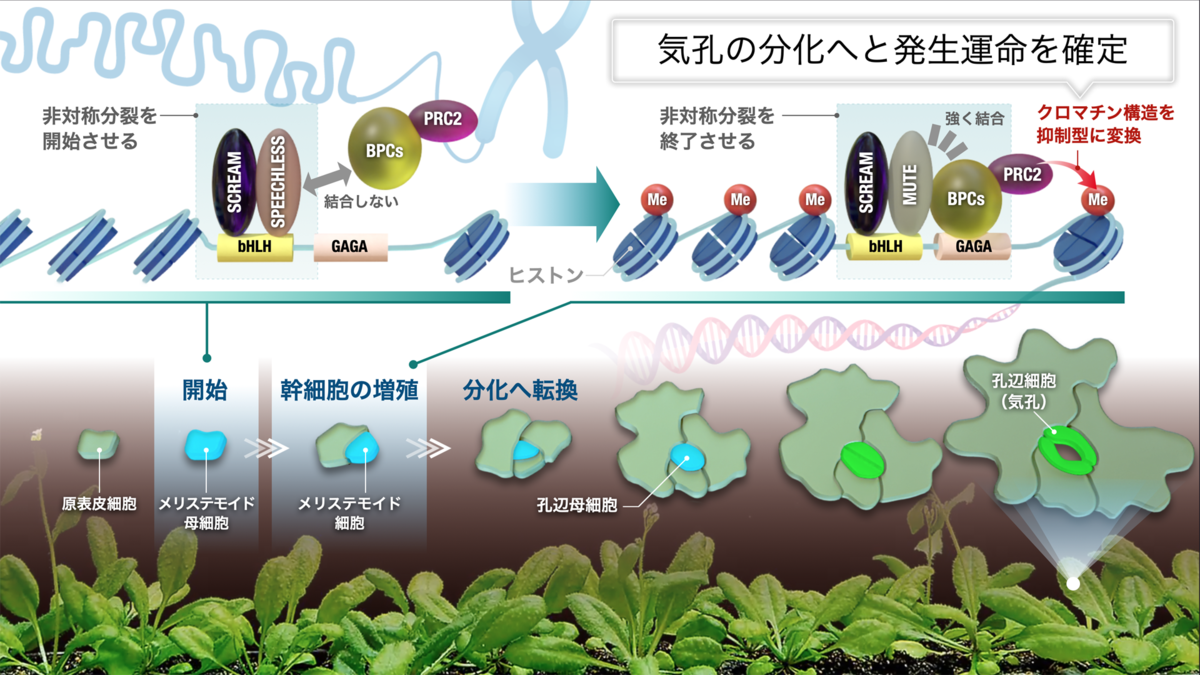
植物細胞の細胞分化は、私たちヒトなど動物細胞と同じく、指令転写因子とエピゲノム(ゲノムの状態)との協調によって遂行すると考えられています。研究グループは、気孔の発生過程におけるダイナミックなゲノム状態の変化(クロマチン•アクセシビリティー注4))を大規模に解析し、気孔の幹細胞状態と関連する2つの異なるDNA配列を同定しました。さらに、その2つの配列に、気孔の分化を指令する転写因子MUTEと、別の種類の転写因子のBPCが結合することを発見しました。BPCは、ヒストン修飾因子注5)を呼び込み、遺伝子発現を物理的に抑制することが知られています。実際に、MUTEとBPCが協調して、気孔の幹細胞遺伝子領域のゲノムの状態を物理的に変化させ、気孔の分化へと発生運命を確定させることが分かりました。
本研究成果は、2022年12月15日付イギリス学術誌「Nature Plants」のオンライン先行版に掲載されました。
【研究背景と内容】
私たちの体で細胞が様々な種類へ分化していく過程では、指令転写因子がDNAに結合して遺伝子発現を制御します。しかしながら、正常な発生過程では、一般に指令転写因子は特定の時期や場所でのみ働き暴走しないと考えられています。これにはゲノムDNAの物理的状態(エピゲノム)が深く関わっており、細胞分化の決定は、指令転写因子とエピゲノムとの協調によって遂行されると考えられています。エピゲノムの制御は、ゲノム上のオープンクロマチン領域注6)と強い相関があり、その動態は、ATACシークエンス法注7)によって網羅的に解析できます。
植物の気孔は、一対の孔辺細胞が穴を囲んだ構造の細胞装置で、葉など光合成器官の表皮に無数に散在し、植物のガス交換と蒸散を担っています。気孔の発生は、未分化な原表皮細胞から幹細胞(メリステモイド細胞と呼ばれる)状態を経た後、分化状態へと切り替わり、孔辺母細胞が一回だけ対称分裂することにより完成します。この細胞状態の切り替わりは、一連の指令転写因子によって行われます。気孔系譜の誕生と幹細胞の維持はSPEECHLESS (SPCH)という転写因子によって、孔辺母細胞への分化の切り替えは、SPCHの姉妹転写因子であるMUTEによって行われます(図1)。これら転写因子の下流因子は既に知られていたものの、気孔系譜の細胞が幹細胞状態から分化状態へどうやって切り替わるのかは分っていませんでした。
今回、研究グループは、気孔の発生過程における、全ゲノム上のオープンクロマチン領域のゲノム状態の変化(クロマチン•アクセシビリティー)を、INTACT注8)-ATACシークエンス法を用いて解析しました。その結果、幹細胞状態から分化状態への転換時に、クロマチン•アクセシビリティー部位が大きく変動することが分かりました(図1)。興味深いことに、幹細胞に特異的なクロマチン•アクセシビリティー部位の大多数(7~8割)に、指令転写因子であるSPEECHLESSとMUTEが結合していることも分かりました。
前述したように、SPEECHLESSは気孔系譜の幹細胞の誕生と維持を担い、MUTEは幹細胞を分化させます。一見、相反する姉妹転写因子が、同じオープンクロマチン領域に結合しているのは何故なのでしょうか。研究グループは、それを明らかにするため、気孔の幹細胞に特異的なクロマチン•アクセシビリティー部位における転写因子の結合部位DNA配列(シス制御領域とも呼ばれる)を抽出したところ、bHLH(E-box)とBPC(GAGA反復配列)という2つの異なるDNA配列が高い確率で共存することが分かりました。bHLH(E-box)という配列には、SPEECHLESSとMUTEが結合します。一方で、BPC (GAGA反復配列)には、BPCと呼ばれる転写因子が結合することが分かっています。さらなる解析から、SPEECHLESSはBPCと結合しない一方で、MUTEはBPCと強く結合することが分かりました。BPCは、抑制型のクロマチンを惹起するPRC2注9)(ヒストンに抑制型の印をつける酵素)を、ゲノム上に連れてくることが知られています。実際に、気孔の幹細胞状態から分化への決定時に、MUTEとBPCが一緒にSPEECHLESS遺伝子のDNAに結合し、BPCがPRC2を介してSPEECHLESS遺伝子周辺のクロマチン構造を抑制型にしてしまうことにより、物理的に幹細胞状態の遺伝子発現が起こらないようにして、分化状態へと転換させることが分かりました(図2)。
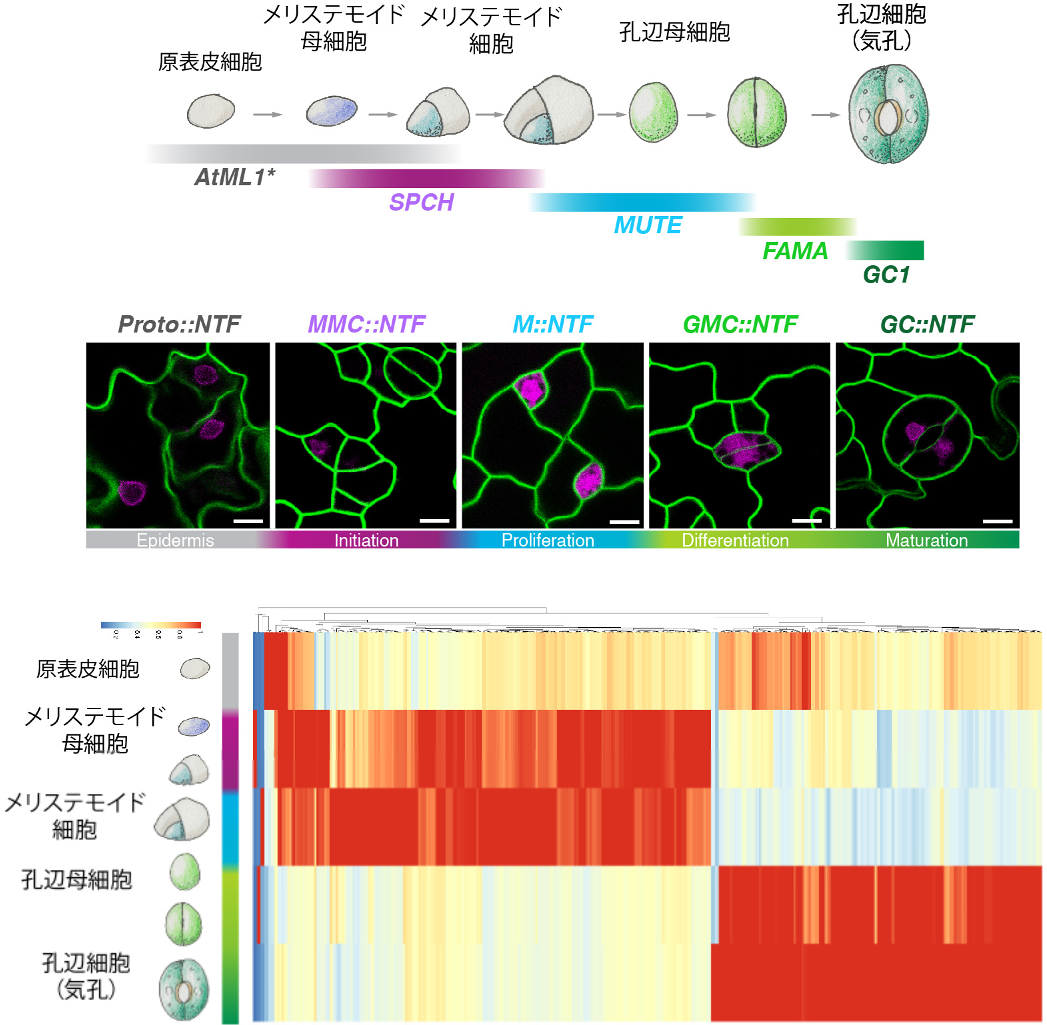
図1:INTACT ATACシーケンス法による気孔の発生過程におけるクロマチンアクセシビリティー領域の解析 (上)原表皮細胞から孔辺細胞(気孔)ができるまでの発生過程と段階的に働く指令転写因子 (中)INTACT ATACシークエンス法で赤色蛍光タンパク質標識された気孔系譜の細胞の核 (下)気孔の発生過程でダイナミックに変動するクロマチンアクセシビリティーサイトのヒートマップ
【成果の意義】
気孔の細胞が発生していく過程では、最初にSPEECLESS、次にMUTEと指令転写因子が順番に、かつ多くはゲノムDNA上の同じ部位に結合することが分かっています。本研究から、一見、SPEECLESSとMUTEは同じように結合している姉妹の指令転写因子ですが、MUTEはBPC(GAGA反復配列)というDNA領域に結合するBPC転写因子と結合することにより、ゲノム状態を物理的に変化させ幹細胞から分化へと切り換えることが分かりました。本研究成果は、指令転写因子が現存するエピゲノム(クロマチン状態)を利用し、かつ能動的に変化させることが細胞分化の鍵となることを明確に示しています。動物の筋肉や神経など重要な細胞の分化も、SPEECLESSやMUTEと同じタイプの指令転写因子が担っています。そのため、それらの仕組みの相違点を追求することにより、動植物を超えた発生原理に迫ることができると期待されます。
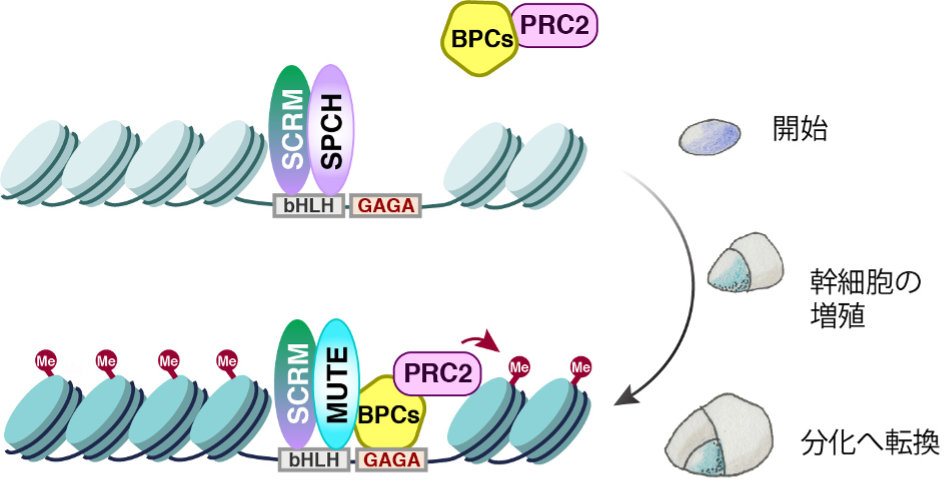
図2:気孔の発生過程において、異なる2つのDNA配列(シス因子)と転写因子(トランス因子)によってゲノム状態が物理的に変化し幹細胞が分化する模式図
本研究は、平成29年度から始まった文部科学省新学術領域研究「植物多能性幹細胞」および名古屋大学高等研究院Young Leaders Cultivationプログラムの支援のもとで行われたものです。
【用語説明】
注1)MUTE:
気孔の分化を指令する転写因子のひとつで孔辺母細胞への分化を促す。
注2)BPC (BASIC PENTACYSTEINE)転写因子:
植物に特異的な転写因子であり、ゲノムDNA上のGAGAの反復配列に結合することが知られている。他グループによる先行研究から、BPC転写因子はPRC2と結合することが報告されている(注9)を参照:Xiao et al. 2017 Nature Genetics 49: 1546-1552)。
注3)クロマチン:
真核生物のDNAは、ヒストンという8量体のタンパク質に巻き付いた構造をとっており、それらを基本単位とするゲノムDNAとタンパク質の高次複合体のこと。
注4)クロマチン•アクセシビリティー:
クロマチンの構造が凝集した状態では、DNAは読み取りにくく、遺伝子が転写されにくい。一方、クロマチン構造が緩んだ状態では、DNAを読み取ることができ、遺伝子が転写されやすい。このクロマチンの緩み具合、つまり転写のされやすさを表す指標。
注5)ヒストン修飾因子:
ヒストンの状態を化学的に変化させる酵素のこと。DNAはヒストンに巻きついているが、ヒストンが修飾を受けるとDNAの巻き付き状態が変化し、遺伝子発現が変化する。
注6)オープンクロマチン領域:
ゲノムDNAのうちDNAがヒストンに巻き付かずに裸になっている領域で、転写因子などが結合している可能性の高い部位のこと。
注7)ATACシークエンス法(アタックシークエンス法):
アタックシークエンス法とは、ゲノムワイドでオープンクロマチン領域を選択的に検出・シーケンスすることによって、クロマチンへのアクセシビリティーをマッピングすることができる方法。トランスポゼース(Tn5)を用いてオープンクロマチン領域を断片化し、同時にタグを付加して次世代シーケンスライブラリーを構築して解析を行う。
注8)INTACT法:
特定の細胞の核のみを標識し迅速に単離する方法。具体的には、特定の細胞(ここでは気孔系譜の各ステップにある細胞)の核マトリクスタンパク質を、ビオチン認識ペプチドと蛍光タンパク質(この論文では赤色蛍光タンパク質RFP)で標識し、ワンステップのアフィニティー精製により核を単離する。
注9)PRC2(Polycomb Repressive Complex2):
動植物を含めて広く真核生物に保存されているタンパク質複合体で、ヒストン修飾酵素として働く。具体的には、H3K27部位をメチル化することにより、クロマチンを抑制する。
Information
| 論文タイトル | Dynamic chromatin accessibility deploys heterotypic cis/trans acting factors driving stomatal cell fate commitment |
|---|---|
| 著者 | Eun-Deok Kim, Michael W. Dorrity, Bridget A. Fitzgerald, Hyemin Seo, Krishna Mohan Sepuru, Christine Queitsch, Nobutaka Mitsuda, Soon-Ki Han, Keiko U. Torii |
| 雑誌名 | Nature Plants |
| DOI | 10.1126/sciadv.abq6161 |
| 発行年月 | 2022年12月 |
