リチウムを用いたメカノケミカル脱水素環化法によるナノグラフェン合成

【ポイント】
・リチウムと原料を固体のままボールミル装置で混合攪拌するメカノケミカル反応注1)
・110年以上の歴史をもつ「脱水素環化(通称グラフェン化)反応」の欠点や未解決問題を克服
・空気下、室温で安全な反応で、5-30分程度でナノグラフェンを高収率で与える
・有機溶媒をほとんど必要とせず、添加量は従来の250分の1程度
・ナノグラフェンの短時間グラム合成や大量供給が可能
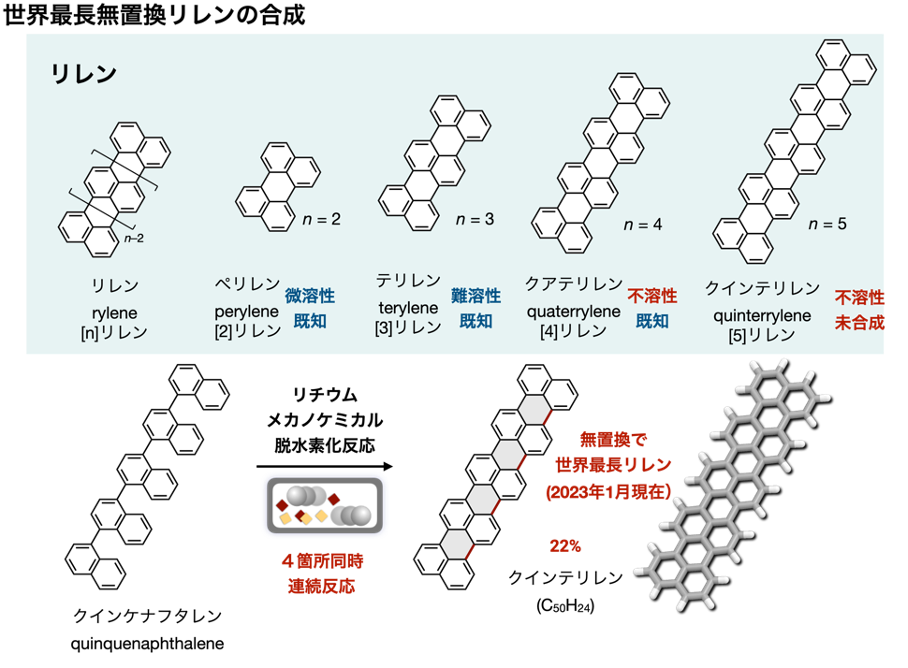
・最長の無置換リレン「クインテリレン([5]リレン)」注2)の合成に世界で初めて成功
【研究概要】
国立大学法人東海国立大学機構 名古屋大学大学院理学研究科の伊藤 英人 准教授、名古屋大学トランスフォーマティブ生命分子研究所(WPI-ITbM※)の伊丹 健一郎 教授、藤代 栞奈 博士前期課程学生らは、効率的かつ迅速なナノグラフェン合成の新手法「リチウムを用いたメカノケミカル脱水素環化反応」の開発に成功しました。
ナノグラフェンは、ベンゼン環が平面上に複数つらなった芳香族炭化水素の総称で多環芳香族炭化水素注3)とも呼ばれており、有機電子材料をはじめとした機能性材料への応用が期待されています。ナノグラフェンは、燃焼後のすすや石油中にも含まれるほど、自然界では身近で豊富な物質ですが、実際に基礎研究や材料へ応用するには、有機合成によって構造を原子レベルで精密に制御する必要があります。
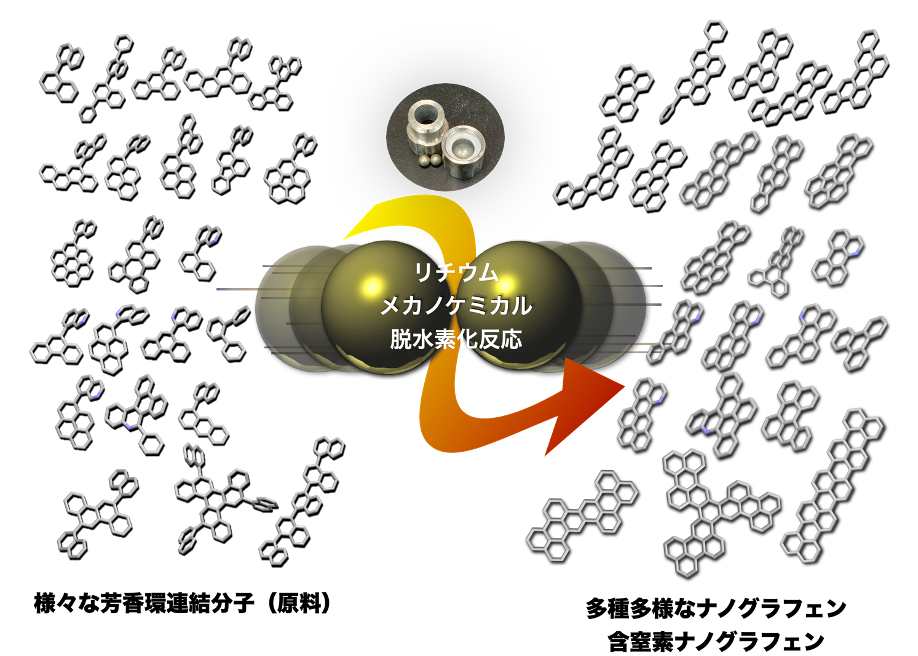
本研究では、ナノグラフェン合成の最終工程の脱水素環化(通称グラフェン化)において、空気中で比較的安全に取り扱えるリチウムを用いて、有機溶媒をほとんど使わずに(従来の250分の1以下)固体状態での迅速合成(最短5分)が可能となる新手法を開発しました。新手法の成功の鍵は、「ボールミル」と呼ばれるステンレス製の粉砕機で固体反応剤どうしを有機溶媒に溶かすことなく機械的に混合攪拌して反応(メカノケミカル反応)させたことにあります。この手法は、市販のリチウムワイヤーから切り出した金属リチウム片の使用を可能にしただけでなく、従来法に比べて、コスト・反応時間・安全性・大量合成の可能性の全ての点で優れた手法といえます。また、これまで合成不可能であったクインテリレンをはじめとする20種類以上のナノグラフェンの短時間・高効率合成が可能となりました。
本研究は、ナノグラフェンをはじめとした機能性芳香族化合物の研究の発展に大きく寄与するだけでなく、化学工業的にみても従来法にとって代わりうる新手法を提案する画期的な成果です。
本研究成果は、2023年4月4日(日本時間)付アメリカ化学会誌「Journal of the American Chemical Society」のオンライン速報版に掲載されました。
【研究背景】
ナノグラフェンは、ベンゼン環が複数つらなった芳香族炭化水素であり、古くから多環芳香族炭化水素とも呼ばれています(図1)。ナノグラフェンは、ベンゼン環のつながり方から天文学的な種類の分子が存在し、身近では燃焼後のすすや石油中、土星の環や星間物質中にも豊富に含まれています。ナノグラフェンは、2010年ノーベル物理学賞の対象となったグラフェンの部分骨格をもつことや、有機電子材料における半導体材料や発光材料となりうることなどから、近年、基礎・応用研究が非常に活発に行われています。また、構成するベンゼン環の数とつながり方で物性が多種多様に変化するため、ナノグラフェン合成には分子を精密に合成する有機合成化学が必要不可欠です。

現在、もっとも汎用されているナノグラフェンの合成方法は、(1)ベンゼン環やナフタレン環などの芳香環をつなげるクロスカップリング反応注4)と、それに続く(2)脱水素環化と呼ばれるグラフェン化反応です(図2)。(1)のクロスカップリング反応は、近年多種多様な方法が開発されている一方、(2)の脱水素環化反応は1910年に開発された塩化鉄などの酸化剤を用いるScholl(ショール)反応注5)と呼ばれる古典的な手法が未だに使われています。Scholl反応は、近年でも年間で100論文以上の報告例がある汎用性の高い反応ですが、合成できないナノグラフェン構造も数多く存在します。たとえば、1,1′-ビナフチルと呼ばれる、ナフタレン2分子が単結合で繋がった化合物からペリレンへと脱水素環化させることは非常に難しいことが知られています。また、窒素原子を含む電子不足な芳香環の脱水素環化も難しいことが知られています。これらの適用限界は、脱水素環化反応が開発されて110年以上経った現在でも解決されておらず、ナノグラフェン合成におけるボトルネックとなっていました。
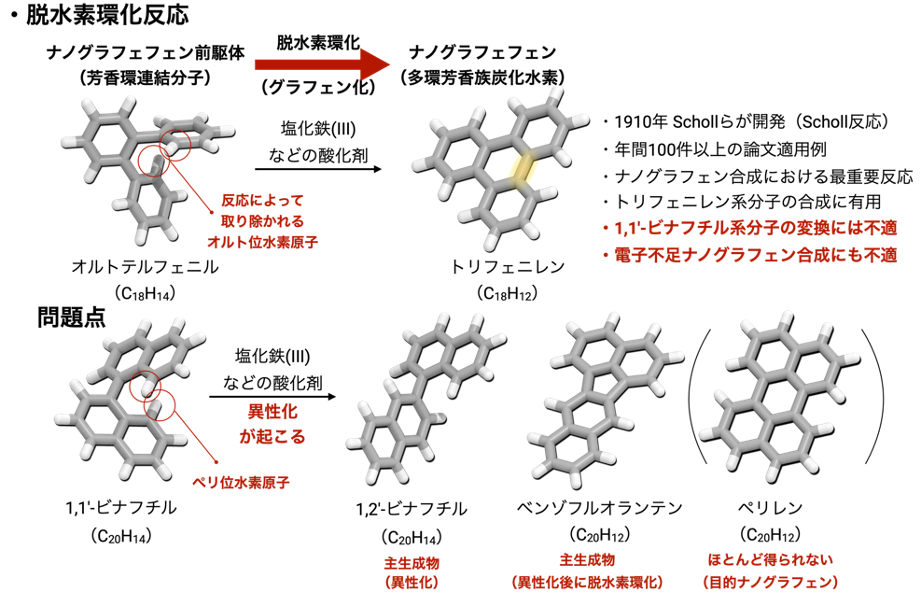
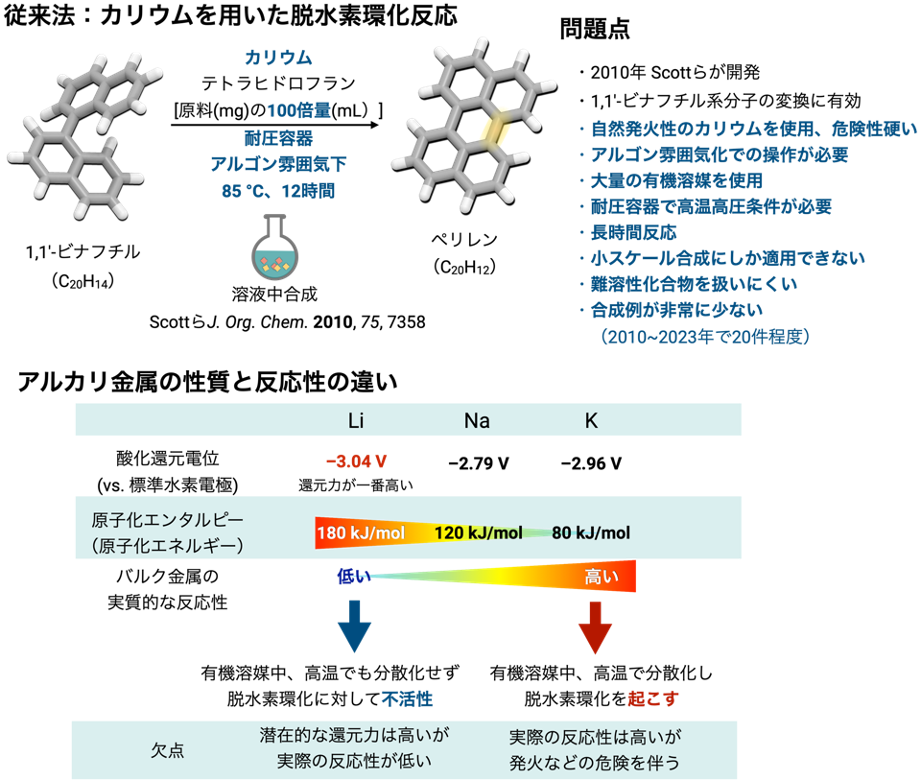
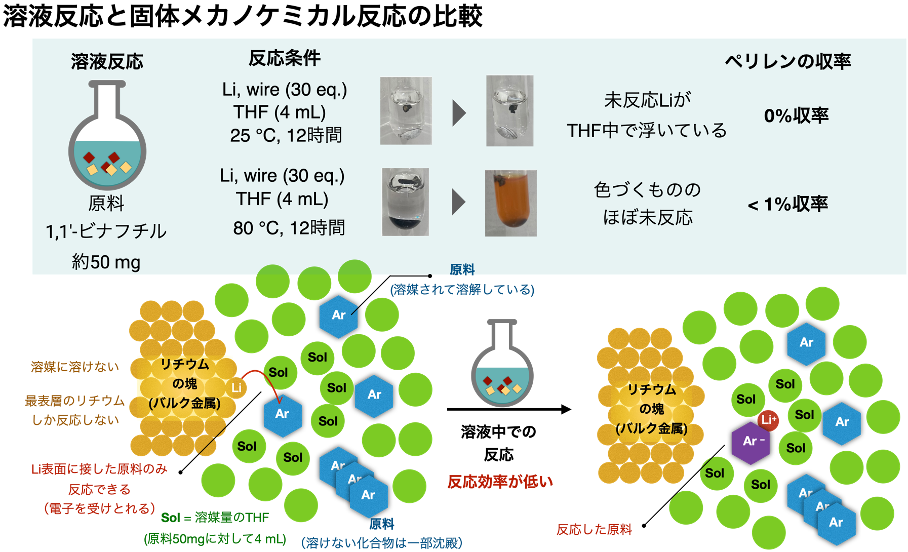
2010年にこれらを解決しうる反応の一つとして、金属カリウムを用いた脱水素環化反応が報告されました(図3上)。この手法は金属カリウムから1,1′-ビナフチルに電子が移動して環化と脱水素化が起こる別の反応機構を経由してペリレンを与えます。しかし、空気中で自然発火する金属カリウムを有機溶媒中、高温高圧条件で加熱撹拌する必要があります。そのため、反応操作時にはアルゴンガス雰囲気下のグローブボックス注6)と呼ばれる装置内で金属カリウムを取り扱う必要があり、反応後処理時にも発火の危険性を伴うなどの安全性と実用性の問題から、この手法はこれまでナノグラフェン合成に部分的にしか用いられてきませんでした。また、ナノグラフェンは平面性が高い分子であり、一般的に有機溶媒に溶けにくい化合物です。このため、原料・中間体・生成物が反応せずに固体として析出してしまうことや、大量の有機溶媒を必要とすること、ナノグラフェンの大量合成が難しいことなどが問題となっていました。
一方、空気中で取り扱い容易な金属としてリチウムが挙げられます。リチウムはリチウムイオンバッテリーとして身近に利用されており、これはリチウムが全金属の中で一番大きな還元力(酸化還元電位注7):-3.04 V)をもっていることに基づきます(図3下)。同じアルカリ金属であるカリウム(酸化還元電位:-2.96 V)よりも還元力が高いため、リチウムを用いた脱水素環化は潜在的に既存法より反応性が高いことが予想されます。しかし、リチウムは全元素の中で一番小さな金属原子であり、金属リチウムの塊(バルク金属)の原子同士は金属結合で強固に結合を形成注8)しているため、バルク金属の状態では反応性に乏しく、また有機溶媒にも溶けないため、従来の有機溶媒中で行う脱水素環化反応には用いることができませんでした。一方で、反応性が低いことは空気中でも比較的安定に取り扱える利点の裏返しとも言えます。
【研究の内容】
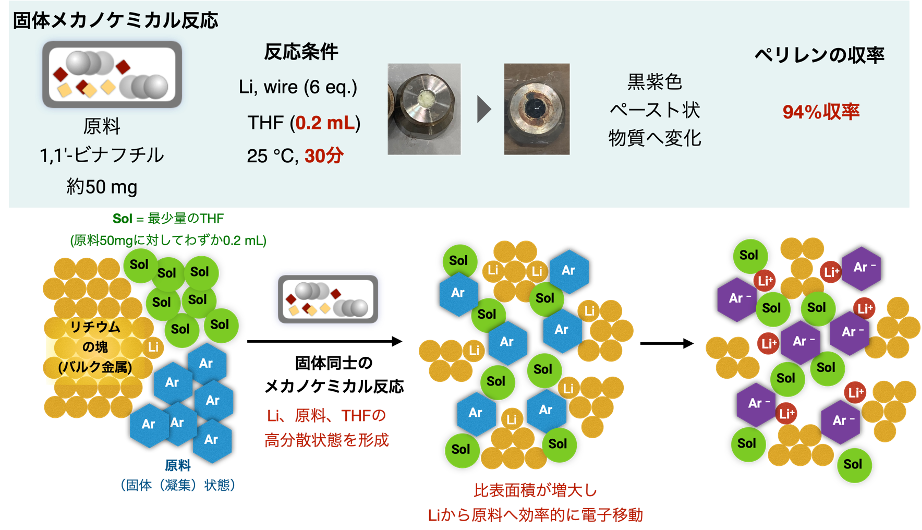
本研究では、効率的かつ迅速なナノグラフェン合成を可能とする新手法「リチウムを用いたメカノケミカル脱水素環化反応」の開発に成功しました(図4)。ステンレス容器に、ナノグラフェンの原料、金属リチウム、ステンレスボールを加えて、粉砕機の一種であるボールミルと呼ばれる装置によって、固体状態のまま高速に振動させながら混合撹拌することで、ペリレン(C20H12)をはじめとする一連のナノグラフェン類が効率的に合成できることがわかりました。また、本手法によってこれまで合成できなかった数多くのナノグラフェンの合成や、空気中での容易な大量合成へと展開できることを明らかにしました。
実際の実験操作
(1)市販のリチウムワイヤー注9)を空気中でハサミを用いて必要量切り出し、原料である1,1′-ビナフチル、ごく少量のテトラヒドロフランを添加剤として加え、空気中でそのままフタを閉める。
(2)この反応容器をボールミルと呼ばれる左右方向に振動させる装置に固定し、室温条件下、1分間に30振動(30 Hz)で高速振動させ、内容物を混合撹拌させる。
(3)3.5-30分後、容器を開封し反応の後処理と単離精製を空気中で行い、ペリレンを単離する。
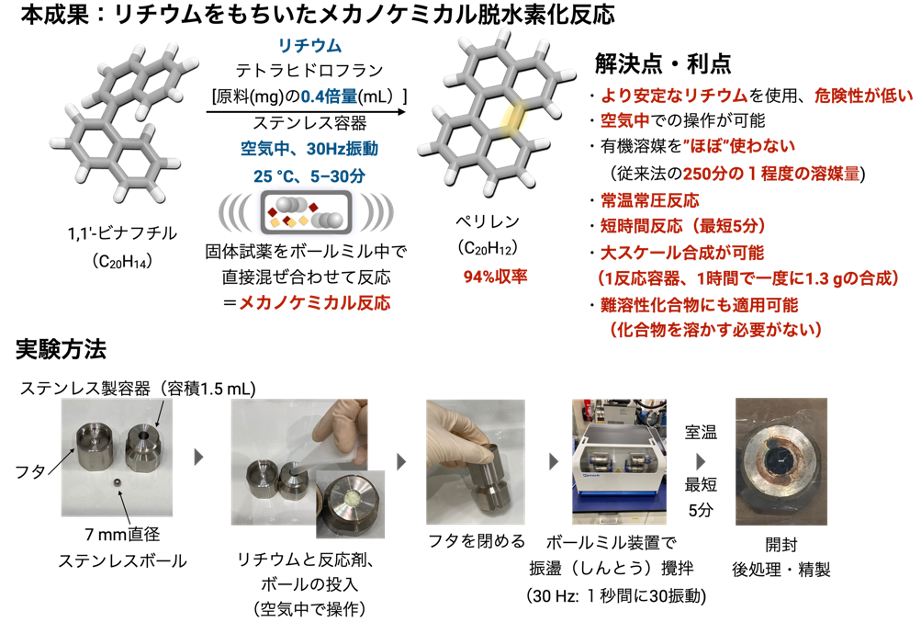
以上の単純かつ迅速な操作によって、わずか30分でペリレンが収率94%で得られることがわかりました。また、反応を5分で停止させても収率91%と、非常に短時間で反応が進行していることがわかりました。従来法であるカリウムを用いた有機溶媒中での脱水素環化反応と比べると、本手法には以下のような学術的な新規性と実用的な利点があります。
学術的新規性:
(1)反応性が低く、分散化も難しいと考えられていた金属リチウムを、固体状態のまま直接機械的にボールミルで混ぜ合わせることで、金属リチウムの高分散状態を作り出すことに成功。これを有機反応に用いることで、リチウムの潜在的に高い還元力が引き出され、従来の溶液中での脱水素環化反応では見られない高活性な反応系が実現(図5)。
(2)開発されて110年以上経過しても未解決だった脱水素環化反応における適用限界を、「リチウムを用いたメカノケミカル脱水素環化法」によって初めて広げることができた。
(3)ペリレン合成以外にも合計20種類以上のナノグラフェンや電子不足な含窒素ナノグラフェンの合成が可能となった。これにより、アルカリ金属を用いた脱水素環化反応において、原料の構造の違いによる反応性や収率の違いについて、初めて網羅的な議論が可能となった(図6)。
(4)難溶解性で有機合成が不可能だった、世界最長の無置換リレン「クインテリレン」の合成を世界で初めて達成(図7下、後述)。
実用的利点:
(1)室温、短時間(5-30分程度)で反応実施が可能(カリウムを用いた従来法では、85℃、12時間以上の加圧加熱攪拌が必要)。
(2)発火の危険性が少なく、空気中で実施可能(カリウムを用いた従来法では、すべての操作をアルゴン雰囲気下で行う必要があり、度々小規模火災の原因となるほど危険な方法であった)。
(3)反応性は低くなるものの、コスト面でリチウムやカリウムより優れた金属ナトリウムが利用できることも発見。
(4)有機溶媒をほとんど用いない固体反応であり、原料を有機溶媒に溶かす必要がない(カリウムを用いた従来法では、100 mgの原料を反応させるためにテトラヒドロフランが100 mL以上が必要なのに対し、リチウムを用いた今回の手法は0.4 mL程度で十分(250分の1))。
(5)原料を有機溶媒に溶解させる必要がないため反応容器が小型となり、3 x 3 x 7 cm程度の大きさの反応容器(内容積10 mL)でも1時間で一度に1.3グラムのナノグラフェンの合成が可能。反応の並列化が容易であり、ボールミル装置1台に反応容器を6つ設置し、反応させれば、10時間で80グラム程度のナノグラフェンの合成が可能。
本研究では、核磁気共鳴(NMR)測定や量子化学計算を用いて、今回のリチウムを用いた固体メカノケミカル反応における活性種や原料の構造による反応性の違いなどについて詳細に検討しました。その結果、リチウムワイヤーから切り出した金属リチウムが白色固体である1,1′-ビナフチルと速やかに反応して、30分以内に黒紫色のペリレンのジアニオンとなることがNMR測定から明らかになりました。また、量子化学計算によって、本反応はまず中性の1,1′-ビナフチルがリチウムによって還元されてジアニオンとなり、環化したのちに水素原子の脱離を伴ってペリレンジアニオンが生成する機構を支持する結果が得られました。1,1′-ビナフチル以外にも様々な芳香環をもつ原料の反応性の違いについても検討し、対応するナノグラフェンを与えやすい(収率が高い)原料と与えにくい(収率が低い)原料の骨格の特徴やその理由を明らかにしました。
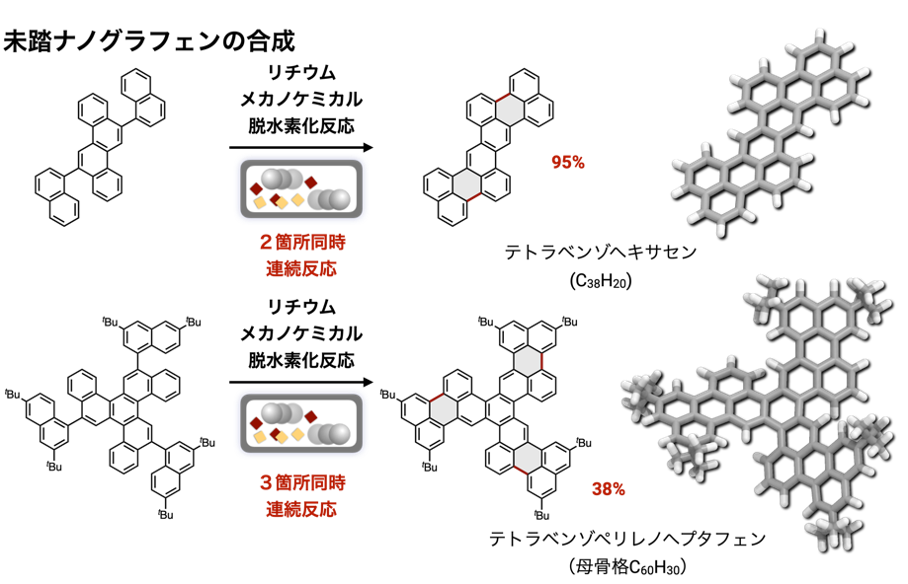
また、反応点が複数箇所にある原料から新規ナノグラフェンの合成にも成功しました(図7上)。例えば、ベンゼン環10個、16個からなる巨大な新規ナノグラフェンが、ナフタレン骨格をもつ原料から高い収率で得られます。さらに、これまで難溶解性のために有機合成では合成不可能と考えられていたクインテリレンの合成も、世界で初めて達成しました(図7下)。クインテリレンのように、ナフタレン骨格が繰り返しつらなった化合物はリレン([n]リレン:nはナフタレンの個数)とよばれ、ナフタレン([1]リレン)、ペリレン([2]リレン)、テリレン([3]リレン)、クアテリレン([4]リレン)などが知られていました。リレンはナノグラフェンの中でも有機電子材料として魅力的であることも知られています。しかし、リレンは高い平面性による分子間相互作用が強く、無置換のクアテリレン([4]リレン)の時点で有機溶媒に全く溶けず、一般的な有機合成法で合成困難な化合物として知られています。そのため、有機溶媒に溶けるように分子間の凝集を抑える目的で傘高いアルキル置換基などをあらかじめ導入しておく必要があり、純粋な無置換のリレンであるクインテリレン([5]リレン、分子式C50H24)の合成は達成されていませんでした。本研究では、開発したリチウムメカノケミカル脱水素環化反応を用い、合成容易なナフタレンを5つもつ前駆体クインケナフタレンから一段階でクインテリレン([5]リレン)を合成することにも成功しました。本成功の鍵は、リチウムメカノケミカル脱水素化反応において、反応剤、原料、中間体、生成物が難溶解性であっても固体状態のまま直接反応させることができた点にあるといえます。固体同士の反応によって、溶液中で見られない飛躍的な反応加速効果が観察されました。また、クインテリレンは難溶解性でしたが、溶媒による簡単な洗浄操作のみで精製・単離することができました。そのため、「有機溶媒にとかして反応させ、生成物を有機溶媒にとかして単離精製する」といった従来の有機合成化学的なアプローチでは合成困難だった巨大なナノグラフェンに対し、本手法が画期的で効果的な次世代の合成手法の一つとなることが予想されます。
【まとめと今後の展開】
本研究では、ナノグラフェンを固体状態で効率的に合成する新手法「リチウムメカノケミカル脱水素環化反応」の開発に成功しました。非常に単純な操作、安全で実用性の高い手法でありながら、クインテリレンをはじめとしてこれまで合成困難であった様々なナノグラフェンの合成に展開できることを明らかにしました。また、リチウムだけでなくコスト面で優れた金属ナトリウムが利用可能なことや、使用する溶媒量が従来の250分の1程度に減らせること、短時間、室温、空気中で大量合成が可能である点も、合成化学的・化学工業的な観点、環境調和型合成やコストの観点から大変魅力的です。脱水素環化反応は世界中の合成化学者がナノグラフェン合成に必ず利用すると言っても過言ではない程、最も重要な反応の一つです。今後、今回開発された反応が広く普及し、未踏ナノグラフェンの合成研究やナノグラフェンの安価な大量供給につながることが期待されます。
【付記】
本成果は、以下の事業・共同利用研究施設による支援を受けて行われました。
IRMAILサイエンスグラント ヴァーダー・サイエンティフィック賞 研究助成金
研究プロジェクト:「ボールミルによるナノグラフェン類の精密ボトムアップ合成」
研究代表者:伊藤 英人
研究期間:2017年4月~2019年3月
戦略的創造研究推進事業(CREST)(JPMJCR19R1)
研究プロジェクト:「レドックスメカノケミストリーによる固体有機合成化学」
研究総括:伊藤 肇
主たる共同研究者:伊藤 英人
研究期間:2020年4月~2023年3月
日本学術振興会 科学研究費補助金 基盤研究B(JP21H01931)
研究プロジェクト:「芳香族性制御によるポストナノカーボン合成化学」
研究代表者:伊藤 英人
研究期間:2021年4月~2022年3月
公益財団法人 立松財団 一般研究助成
研究プロジェクト:「ナノカーボンの多様性指向型精密有機合成」
研究者代表者:伊藤 英人
研究期間:2023年8月~2024年9月
日本学術振興会 科学研究費補助金 特別推進研究(JP19H05463)
研究プロジェクト:「未踏分子ナノカーボンの創製」
研究代表者:伊丹 健一郎
研究期間:2019年4月~2022年3月
計算科学研究センター(Research Center for Computational Science) 施設利用
研究代表者:伊藤 英人
研究期間:2021年4月~2023年3月
課題番号:21-IMS-C070, 22-IMS-C069
京都大学化学研究所スーパーコンピュータシステム 施設利用
研究代表者:伊藤 英人
研究期間:2022年10月~2023年3月
【用語説明】
注1)メカノケミカル反応:
一般に、有機合成では、反応剤同士を有機溶媒中に溶かして混合する必要があり、1グラムの反応試薬に対して100 mL〜1 L程度の溶媒が必要となる。研究室レベルの実験では比較的簡単に実施できるが、工業化の際に大スケール化が難しい(非常に多くの有機溶媒を必要とする、反応熱の制御が困難、収率や再現性が低下する)といった問題点がある。これに対して、近年、固体反応剤同士を機械的に直接混和して反応させるメカノケミカル反応が注目を浴びている。ボールミルなどの粉砕機を用いたメカノケミカル反応では、反応剤と攪拌用ボールを反応容器に加えて容器自身を直接機械的に振動させて内容物を混合することで反応を行う。有機溶媒をほとんど用いないこと、反応が短時間で完結すること、大量合成が容易であるなどのコスト・効率面での実用的な利点だけでなく、有機溶媒中では起こらない化学反応や現象がみられるなど、近年注目を浴びている。
注2)クインテリレン([5]リレン):
ナフタレン骨格が5つつらなった純粋な無置換のリレン化合物(分子式C50H24)。ナフタレン骨格が繰り返しつらなった化合物はリレン( [n]リレン:nはナフタレンの個数)と呼ばれ、ナノグラフェンの中でも有機電子材料として魅力的であることが知られている。リレンには、ナフタレン([1]リレン)、ペリレン([2]リレン)、テリレン([3]リレン)、クアテリレン([4]リレン)などがあるが、これらは高い平面性による分子間相互作用が強く、有機溶媒に全く溶けず、一般的な有機合成法で合成困難な化合物として知られている。そのため、有機溶媒に溶けるように分子間の凝集を抑える目的で傘高いアルキル置換基などをあらかじめ導入しておく必要があり、これまで純粋な無置換のクインテリレンの合成は達成されていなかった。
注3)環芳香族炭化水素:
ベンゼンやナフタレンよりも多くの芳香環をもつ芳香族炭化水素の総称であり、比較的小さな分子にはアントラセン、フェナントレン、ピレン 、ペリレン、コロネンなどの慣用名がある。英語略称名でPAHとも呼ばれる。
注4)クロスカップリング反応:
パラジウム触媒などをもちい、芳香族化合物同士を結合させる反応。鈴木・根岸・Heckらに与えられた2010年のノーベル化学賞の対象反応としても有名であり、1970年代から主に日本で盛んに研究されてきた。
注5)Scholl(ショール)反応:
ベンゼン環が連結した化合物に対して、塩化鉄(III)などを用いると水素原子の脱離を伴いながら環化して平面構造をもつ多環芳香族化合物が合成できる反応全般を指す。1910年、Schollらによって初めて報告された反応であり、現在ではナノグラフェン合成に欠かせない反応の一つとなっている。
注6)グローブボックス
空気(酸素、水)に対して不安定な化合物を扱う際に、密閉型の大きな箱内に窒素ガスやアルゴンガスを充填し、外からゴム製のグローブを介して化合物を扱うことができる装置。簡易の小型の箱状のものから、冷蔵庫や溶媒取り出し口などがついた大型のものがあるが、装置そのものやアルゴンガスが高価であることや、脱酸素や脱水状態維持すためのランニングコストが大きい。
注7)酸化還元電位:
電極反応における化合物の酸化と還元の起こりやすさの指標。例えば、Li2+ + 2e- ⇄ Li0の反応における標準酸化還元電位は-3.04 Vであり、負に大きな値なのでLi+が還元されにくいことを指す。逆に、Li0は電子を他に与えて失い易い(還元力が高い)ことを意味する。Liは全金属単体の中で最も負に大きな酸化還元電位をもっており、還元力が高い。
注8)金属結合で強固に結合を形成:
バルク金属中の金属結合がどのくらい強いかについては原子化エンタルピー(エネルギー)という指標が参考になる。これは、全ての結合をバラバラにして原子に分解するのに必要なエンタルピ(エネルギー)に相当する。原子化エンタルピーはリチウム、ナトリウム、カリウムの順に180, 120, 80 kJ/molとされている。つまり、リチウムが一番バラバラにしづらく、カリウムがバラバラにしやすい。この違いは、実際の有機合成におけるアルカリ金属の性状(硬さ・融点)や反応性に現れている。例えば、リチウムは原子として潜在的な還元力は高いが実際のリチウム塊は硬い金属であり、融点も高く、バラバラになりにくいため実質的な反応性は低い。
注9)リチウムワイヤー:
金属リチウムを取り扱いしやすいように直径3 mm程度のワイヤー上に加工したもの。空気中の水分、酸素、窒素との反応を防ぐために、ミネラルオイルに浸けた状態で市販化されている。取り扱いが容易であり、ハサミで切り出して使用することができる。

Information
| 論文タイトル | Lithium-Mediated Mechanochemical Cyclodehydrogenation |
|---|---|
| 著者 | 藤代 栞奈、森中 裕太、小野 洋平、田中 剛、 Lawrence T. Scott、伊藤 英人、伊丹 健一郎 |
| 雑誌名 | Journal of the American Chemical Society |
| DOI | 10.1021/jacs.3c01185 |
| 発行年月 | 2023年4月 |
