環を開いて価値を生む 新しいクロスカップリング反応を開発 ~光学活性な有機硫黄化合物の立体制御を実現~
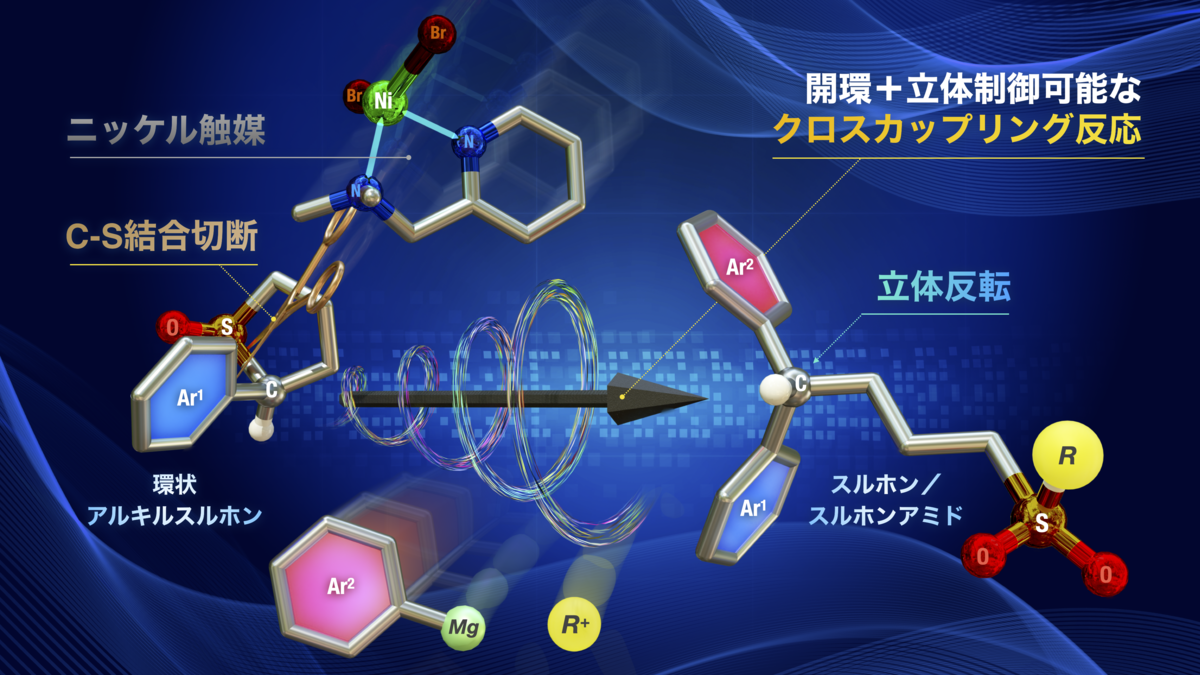
【研究概要】
・光学活性な環状のアルキル注1)スルホン注2)の開環と立体制御を同時に可能にする新形式のクロスカップリング反応注3)を開発
・入手と調製が容易な試薬を用いて実施することが可能であり、従来合成自体が困難な光学活性な有機硫黄化合物の合成が可能
・有機硫黄化合物の新しい活用法の提示のみならず、新しい医農薬品や有機材料の開発への貢献が期待される
【研究概要】
名古屋大学トランスフォーマティブ生命分子研究所(WPI-ITbM) のCathleen Crudden (キャサリン クラッデン) 主任研究者/客員教授、南保 正和 特任准教授、Roberto Nolla-Saltiel (ロベルト ノーラ-サルティエル) 研究員らの研究グループは、東京大学の横川 大輔 准教授らと共に、ニッケル触媒を用いた光学活性な環状アルキルスルホン類の炭素-硫黄結合の切断と立体制御を同時に可能にする新形式のクロスカップリング反応を開発しました。
スルホンのクロスカップリング反応は、1979年に初めて報告されて以来、現在に至るまで、生成物の立体制御に成功した報告はなく、本研究が世界初の例となります。
本手法は入手・調製容易な試薬を用いて実施することが可能であり、従来合成自体が困難な光学活性な有機硫黄化合物を合成することができました。
本手法の開発によって、これまでほとんど注目されてこなかった有機硫黄化合物の新しい活用法が提示できたのみならず、新しい医農薬品や有機材料の開発への貢献が期待されます。
本研究成果は、2024年8月5日付イギリスの科学雑誌「Nature Chemistry」のオンライン版に掲載されました。
【研究背景と結果】
有機硫黄化合物の1つであるスルホンは、様々な機能性材料や医農薬品に含まれる重要な骨格であると同時に、優れた反応剤として古くから有機合成に利用されてきました。スルホンは、化学的に安定かつ保存や調製が容易である特徴を有し、近年ではクロスカップリング反応における有用なビルディングブロックとして再度注目を集めています。スルホンを用いるクロスカップリングの研究は、1979年Wenkertらの初めての報告以降、多くの研究者が取り組んできました。しかしながら、不斉炭素を有するキラル注4)なアルキルスルホン類に対する立体化学の制御を伴ったクロスカップリング反応の報告例はありませんでした。
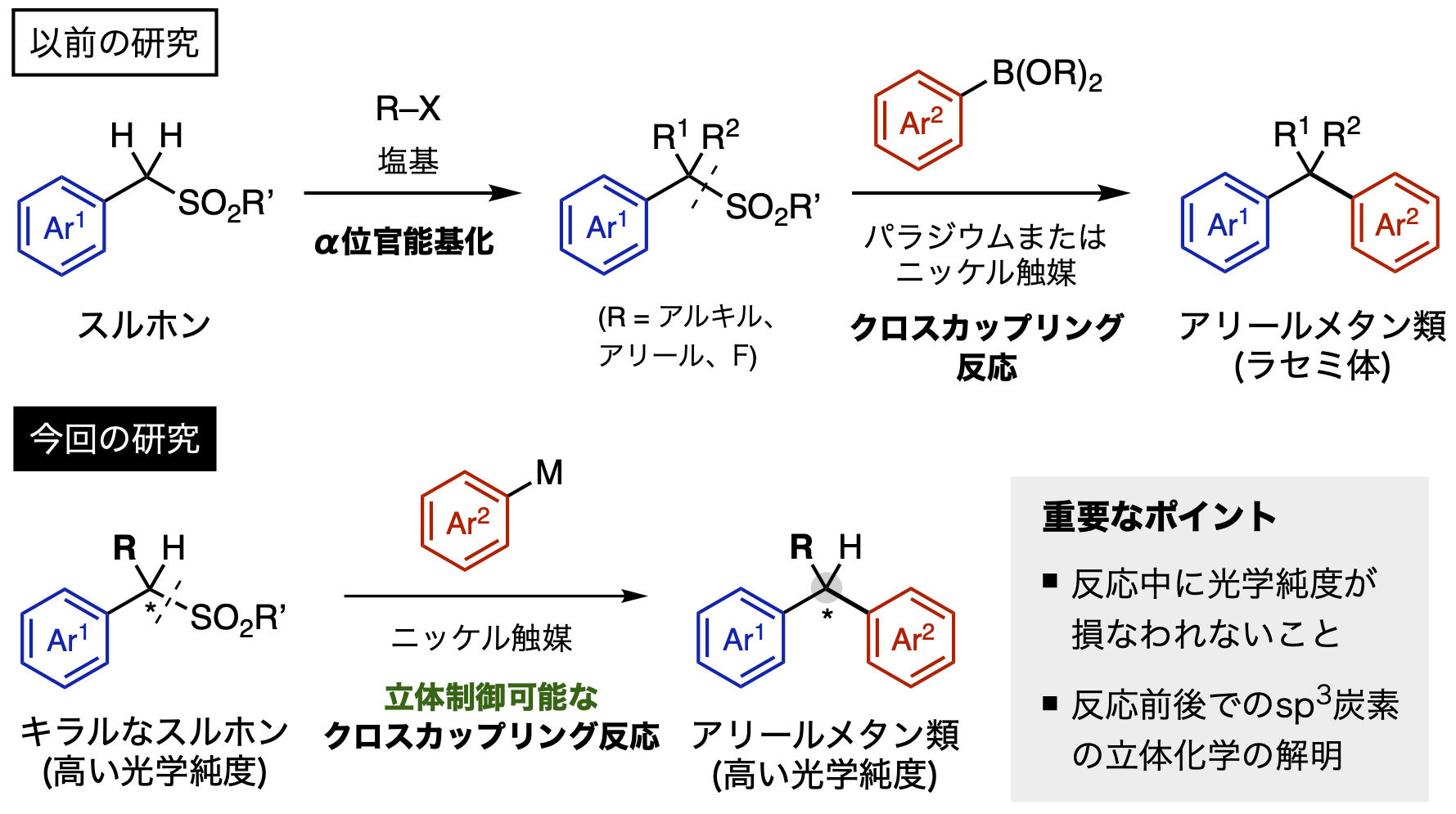
Crudden(クラッデン)主任研究者/客員教授、南保 特任准教授らの研究グループは、これまでにスルホンを鋳型として様々な有用分子群の自在合成法に取り組んできました。例えば、パラジウムやニッケルなどの金属種が、炭素-硫黄結合を切断しつつ別の新たな結合を形成するクロスカップリング反応に有効な触媒となることを見出し、1つの炭素上が高度に官能基化されたアリールメタン類の迅速自在構築に成功しています(図1)。
これらの知見を元に研究グループは、次にキラルなスルホンの立体化学の制御も両立できる新たな手法の実現に挑戦しました。その戦略は光学純度注5)の高いキラルなアルキルスルホンを基質に用い、その不斉炭素の立体化学の情報を生成物へそのまま転写できる新しいクロスカップリング反応を開発するというものです。この戦略実現における重要なポイントは、1)基質の光学純度が損なわれる(ラセミ化する)ことなくクロスカップリング反応が進行すること、2)反応前後で炭素中心の立体化学はどうなっているか(保持するか反転するか)を明らかにすることにあります(図1)。
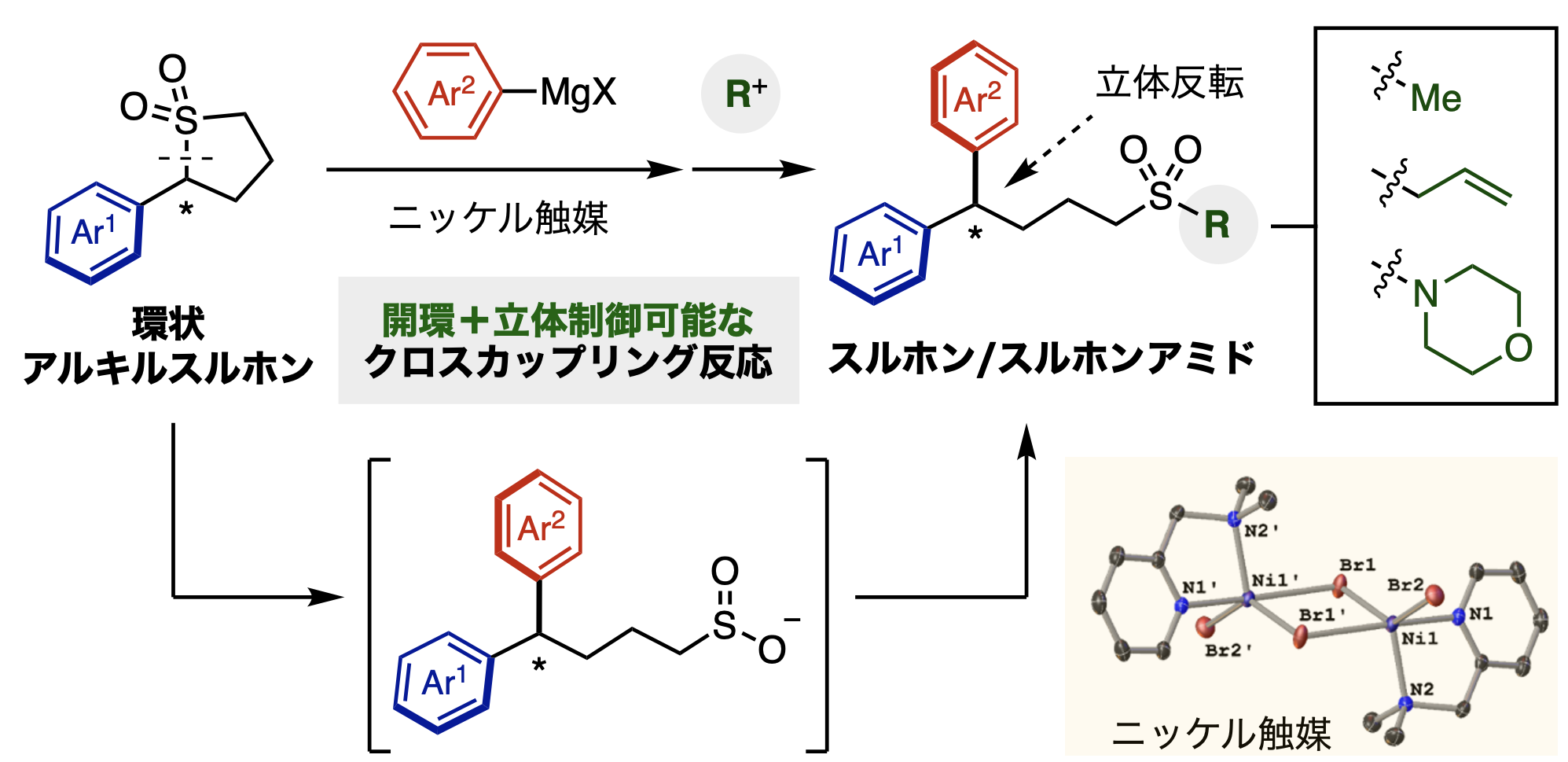
研究グループは、キラルな環状アルキルスルホンの開環を伴う新形式のクロスカップリング反応の開発に成功しました。すなわち、ニッケル触媒が環状アルキルスルホン類の炭素-硫黄結合を選択的に切断、続く有機マグネシウム試薬とのカップリングを促進することで、不斉炭素を有する化合物群を得ることに成功しました(図2)。
この反応を光学純度の高い基質を用いて行うと、得られる生成物も高い光学純度が維持されていました。その化合物を単結晶X線構造解析にて基質と生成物の立体化学を調べたところ、反応の前後で炭素中心上の立体化学が反転していることが明らかになりました(図2)。さらには、コントロール実験によって、基質のラセミ化よりもクロスカップリング反応が非常に速く進行しており、その結果、高い光学純度が維持されることが分かりました。この興味深い反応機構に関しては、量子計算化学を駆使した解析によってその妥当性が検証されています。
カップリング反応後に生じるアニオン種は反応剤と反応させることで、様々なスルホンあるいはスルホンアミドへと誘導することができました。これらの分子群は医農薬品や有機材料に頻繁に見られることから、本手法はこれら有用な骨格を一挙に構築できる強力な手法になると言えます。
【成果の意義】
本研究により、ニッケル触媒を用いることでキラルな環状アルキルスルホンの開環を伴う新形式のクロスカップリング反応を世界で初めて達成しました。本手法は入手・調製容易な試薬を用いて実施することが可能であり、従来合成自体が困難な光学活性な有機硫黄化合物の新しい合成戦略を提示するものです。また不活性な炭素-硫黄結合を切断することは合成化学上未だ困難な課題であり、本研究で得られた知見はその課題を解決する新たな触媒の開発につながると考えられます。
本手法の開発によって、これまでほとんど注目されてこなかった有機硫黄化合物の新しい活用法が提示できたのみならず、新しい医農薬品や有機材料の開発への貢献が期待されます。
【付記】
本研究は、日本学術振興会科学研究費助成事業(17K17805、21K05068)の支援のもとで行われたものです。
【用語説明】
注1)アルキル:
飽和炭化水素(アルカン)から水素原子1個を除いた官能基。
注2)スルホン:
有機硫黄化合物の1つであり、硫黄上が2つの炭素と2つの酸素が結合している分子の総称。
注3)クロスカップリング反応:
2つの異なる分子どうしを選択的につなぐ有機合成化学における革新的な反応。日本人の研究者が分野の発展に大きく貢献し、多くの人名反応が存在する。2010年に根岸英一先生、鈴木章先生がノーベル化学賞を受賞。
注4)キラル:
左手と右手が鏡像の関係であるように、空間的な位置関係が違うために重ね合わすことが出来ない性質。
注5)光学純度:
キラルな分子同士は光学異性体と言われ、その異性体の比率のこと。
光学純度が高い場合、どちらか片方の異性体に偏っていることを意味する。
Information
| 論文タイトル | Enantiospecific Cross-coupling of Cyclic Alkyl Sulfones |
|---|---|
| 著者 | Roberto Nolla-Saltiel、Zachary T. Ariki、Stefanie Schiele、Jana Alpin、田原 康予、横川 大輔、南保 正和*、Cathleen M. Crudden* (*は責任著者) |
| 雑誌名 | Nature Chemistry |
| DOI | 10.1038/s41557-024-01594-x |
| 発行年月 | 2024年8月 |
